ベンゼンのHとハロゲンの置換反応について、以下のような反応機構で進むことを学習しました。

Br分子は極性を持たないので、そのままではベンゼンと反応しません。
そこでFeBr3触媒を用いてBr分子を分極させることで、ベンゼンのπ結合と反応が起きるようにします。
そういえば以前に学習したエチレンにBr分子が付加する反応でも、Br分子が分極してπ結合と反応しましたね。
ですが、エチレンへの付加反応の場合は、触媒を使わなくてもBr分子が分極してπ結合と反応していました。

注目しないといけないのは、π結合と一口に言ってもエチレンのπ結合とベンゼンのπ結合は反応のしやすさが違うということです。
エチレンの場合のπ電子は比較的弱い結合で反応性に富むため、Br分子に近づくことでBr分子が分極するのでした。
ところがベンゼンの場合はπ結合同士で共鳴しており非常に安定しているため、反応性が低いのです。
そのため触媒によってBr分子を分極させる必要がありました。
さて、ハロゲンの代表的なものとして、Brの他にF、Cl、I、があります。
Clの反応はBrの場合と同様に進むのですが、FとIの反応はこれらと異なるようです。
調べた結果、
・Fの場合は触媒がなくても反応が進む
・Iの場合は反応が起こりにくい
ということです。
参考)http://猫でもわかる有機化学.net/benzene-reaction-1/
その理由ですが、
Fについては、電気陰性度が関係します。
Fの電気陰性度は最も強く、相手から電子を奪おうとする力が強いです。
そのため触媒がなくてもベンゼンのπ電子と反応するのです。
ではIの場合はというと、結合エネルギーに注目して考えることができます。
「ボルハルトショアー現代有機化学(下)」に反応に関係する結合エネルギーが掲載されていましたのでF、Cl、Br、Iについて計算してみました。
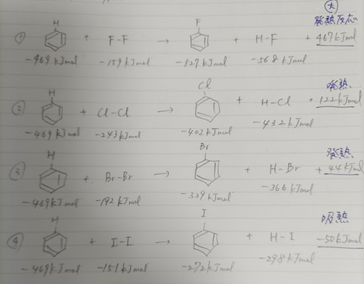
先ほど反応が起きやすいと説明したFの場合は、確かに大きな発熱反応になっています。
ClとBrの場合も発熱反応ですが、Iの場合は吸熱反応となっています。
つまり、外部から反応を起こすためのエネルギーを与えないと起こりにくい反応というわけです。
以上ベンゼンのハロゲン化についてまとめました。
4/27(土)学習時間:13.25H
・岡野の化学(38)~(40)
・ベンゼンのハロゲン化について
・アルケンとハロゲンの付加反応について復習
・ベンゼンのスルホン化、ニトロ化についての英文資料を読む
(課題)
関連する特許に関する調査があまりできていないので、特許庁のデータベースで関連する内容を探すようにする







コメントを残す