前々回の投稿で、酸性の強さは共役塩基のイオンの安定性に関係するということを学習しました。
この考え方を使って-OH基をもつフェノールとカルボン酸が酸性になる理由を説明できます。
フェノールとカルボン酸からそれぞれH+がとれたイオンの状態を考えてみます。
フェノールの場合
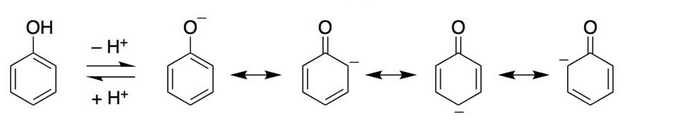
上図のようにフェノールからプロトンがとれた共役塩基のイオン(フェノキシドイオン)は、ベンゼン環のπ結合とO原子のp軌道が共役し共鳴構造が書けます。
カルボン酸の場合

カルボン酸も同じく、上図のようにカルボン酸(図は酢酸ですが、CH3の部分をR基にして一般化できます)からプロトンがとれた共役塩基のイオン(カルボキシラートイオン)は、C-Oのπ結合とO原子のp軌道が共役し共鳴構造が書けます。
共鳴構造が書けるということは電子が非局在化しているということであり、電子が非局在化するほど安定化します。
このため、フェノールとカルボン酸は電離しやすく、酸性を示すということになります。
ではベンジルアルコールはどうでしょうか。
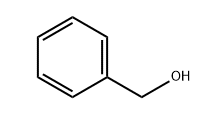
この場合はOH基がベンゼン環に直接ついているわけではないので、共役塩基のイオンの共鳴構造が書けません。
ベンジルアルコールは酸性を示さない、という結論になります。
と、ここまで考えたところで、講義動画にこのテーマに関連しそうなタイトルがあるのを発見。
講義動画「1083 σ結合 π結合 酸性 共役」を視聴したところ、全く同じテーマの解説でした。
先に見ておけば時間短縮だったかなと思いつつ、今までに学習した「電子の非局在化による安定化」「共役・共鳴」「酸と共役塩基のイオンの安定性の関係」というテーマから自分で考えて同じ結論を導き出せたのは少し自信になりました。
4/23(火)学習時間:5H
・岡野の化学(32)(33)
・1083 σ結合 π結合 酸性 共役
・-OH基の酸性についてまとめ
課題)
アルコールとエーテルのOをSに置き換えた化合物でチオールとスルフィドがあるということを知る。
→Sに代わることでどんな性質を持つようになるか、どのように工業利用されているかを調べる。






コメントを残す