前回の記事で腸溶性錠剤について前提となる知識を大まかに確認したので、実際の特許明細書を読んでみました。
特許請求の範囲
まず請求項を確認します。
請求項は1~6までで以下に引用した通りです。
【特許請求の範囲】
【請求項1】
1)1-[2-(2,4-ジメチルフェニルスルファニル)フェニル]ピペラジンまたはその塩を含有する核錠、
2)a)メタクリル酸コポリマー、ヒプロメロースフタレート、ヒプロメロースアセテートサクシネート、セルロースアセテートフタレートおよびポリビニルアセテートフタレートから選択される1種または2種以上のポリマー成分、および、b)前記ポリマー成分に対して重量比40%以下の重量のタルク、を含有し、かつ、c)アルカリ成分を実質的に含有しない、
ことを特徴とする腸溶性被覆層、
を有する腸溶性錠剤。
【請求項2】
腸溶性被覆層において、ポリマー成分が、
1)メタクリル酸、および、
2)メチルアクリレート、エチルアクリレート、および、メチルメタクリレートから選択される1種または2種以上のモノマーから構成されるメタクリル酸コポリマー、
である請求項1に記載の腸溶性錠剤。
【請求項3】
腸溶性被覆層において、メタクリル酸コポリマーが、
1)メタクリル酸、および、エチルアクリレートとのコポリマー、
2)メタクリル酸、および、メチルメタクリレートとのコポリマー、または、
3)メタクリル酸、メチルアクリレート、および、メチルメタクリレートとのコポリマー、
である請求項2に記載の腸溶性錠剤。
【請求項4】
腸溶性被覆層において、タルクの重量がポリマー成分に対して重量比10から25%である請求項1に記載の腸溶性錠剤。
【請求項5】
腸溶性被覆層が、さらに可塑剤を含有するものである請求項1に記載の腸溶性錠剤。
【請求項6】
ポリマー成分の配合量が、核錠の表面積との換算で、4から6mg/cm2である請求項1に記載の腸溶性錠剤。
【請求項1】の内容を簡単に図に整理してみました。
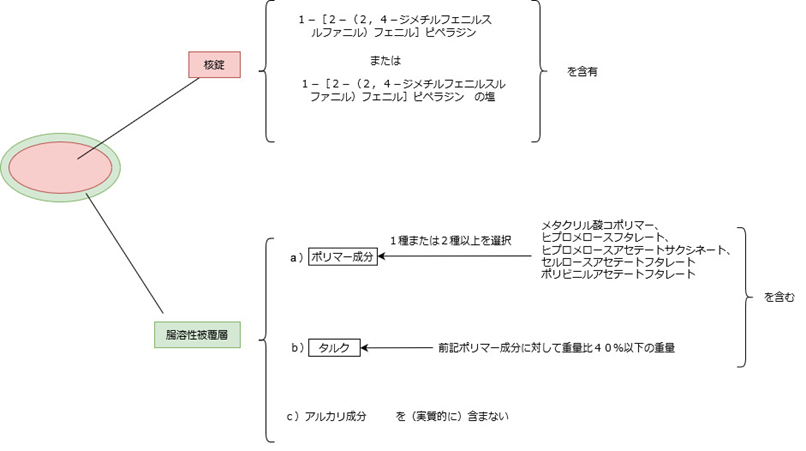
この特許の権利対象は最もシンプルに言うと「腸溶性錠剤」です。
この腸溶性錠剤は大きく分けて、
有効成分を含む核錠部分と、
核錠をコーティングする腸溶性被覆層部分、
に分けられます。
そして、それぞれの成分について限定があります。
核錠は、
1-[2-(2,4-ジメチルフェニルスルファニル)フェニル]ピペラジンまたはその塩
を含有することとされています。
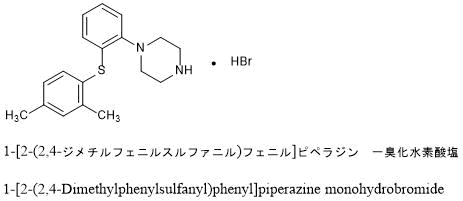
1-[2-(2,4-ジメチルフェニルスルファニル)フェニル]ピペラジンは、調べたところWO 03-029232の特許で最初に開示された化合物で、うつ病やパニック障害といった情動障害に対して薬理作用をもつ有効成分とのことです。
「またはその塩」とされていますが、下のような臭化水素塩の形で使われることが多いようです。
腸溶性被覆層は、
ポリマー成分とタルクを含み、アルカリ成分を実質的に含まない、とされています。
「アルカリ成分を実質的に含まない」というのは、意図的に配合しないという意味で、微量であって錠剤の効果に影響を与えない程度であれば無視できるということです。
明細書の中には、「耐酸性や崩壊性、有効成分の溶出性等の錠剤特性に影響を及ぼさないような微量のアルカリ成分の有無は問わない」という説明があります。
アルカリ成分を含まないという点はこの特許の肝になるので、後ほど取り上げます。
ポリマー成分の具体的な物質名とタルクの重量についても限定されていますが、それぞれ続く請求項でさらに細かく限定されます。
【請求項2】と【請求項3】では、【請求項1】の(a)のポリマー成分の中で、特にメタクリル酸コポリマーについて、構成要素のモノマーに限定を加えています。
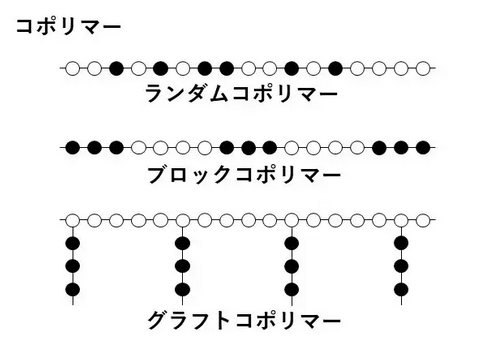
ポリマーにはホモポリマーとコポリマーがあり、ホモポリマーは1種類のモノマーからなるポリマー、コポリマーとは2種類以上のモノマーによって構成されるポリマーです。
ひもなしでくっつけて遊べるハニ―アートビーズというものがあるそうですが、同じパーツばかりを長くつなげたものがホモポリマー、いくつかのパーツを選んで組み合わせて長くつなげたものがコポリマー、というイメージです。

コポリマーの場合には各パーツをどのように組み合わせるかによって、ランダムコポリマー、ブロックコポリマー、など種類が分かれますが、この特許ではこれらの重合方法については特に指定されていません。
【請求項3】の内容は【請求項2】の具体的な組み合わせを示したものです。
・【請求項3】がなくても【請求項2】でカバーされているのでは?
・【請求項3】に示されていない「メタクリル酸、および、メチルアクリレートとのコポリマー」などは対象外にならないの?
と疑問が出てきましたが、
先を読み進んだところ、【請求項3】の3種類のパターンは、【発明の詳細な説明】の中で特に好ましい例として挙げられていました。
【請求項1】では色々なポリマー成分を挙げていますが、その中でも特にメタクリル酸コポリマーに言及しているのも、メタクリル酸コポリマーを使うことが好ましいと考えているためです。
【請求項2】はより上位概念として【請求項3】の権利範囲を広く保護し、【請求項3】は特に効果的と考えられる組み合わせや、後に示される実施形態に対応する内容に限定して、特許の内容をより具体的に明確に示しているものと思われます。
【請求項4】はタルクの重量をさらに限定したものです。
この点はアルカリ成分を含まないという点と合わせて特許の肝の部分になります。
【請求項5】被覆層に可塑剤を加えた場合を考慮しています。
前提知識として調べた内容で、可塑剤はポリマーに柔軟性を与え、コーティングの割れや剥がれを防ぐ効果を狙って添加されるものということだったので、可塑剤を用いる可能性も十分に考えられます。
【請求項6】ポリマー成分の配合量に関して限定したものです。
「錠剤の表面積との換算」としているのは、重量だと錠剤のサイズや形状によって基準にブレが出てしまうためだと考えられます。
錠剤の表面積との換算にすることで、錠剤のサイズや形状によらず、一定の面積あたりの配合量を比較できます。
発明の詳細な説明
今回の特許の要点を確認する前に、まず発明の背景を押さえておきます。
腸溶性錠剤としては、薬剤を胃から保護するなどの目的でメタクリル酸コポリマーを腸溶性被覆剤に使用する例が広く知られていました。
ポリマーの分散性を向上させる目的で重曹、水酸化ナトリウム、炭酸ナトリウム、炭酸マグネシウムなどのアルカリ成分を加えた腸溶性被覆剤も市販されていました。
また、腸溶性被覆剤中の滑沢剤としてポリマー成分に対して重量比50%のタルクを使用することが好ましいとされていました。
アルカリ成分とポリマーの分散性
ポリマーの分散性向上のためにアルカリ成分を加えるというのはどういうことでしょうか。
腸溶性被覆剤のポリマー成分の例として、
メタクリル酸とエチルアクリレートのコポリマーで考えてみます。
エチルアクリレートはアクリル酸エチルとも呼ばれ、アクリル酸とエタノールをエステル化したものです。
アクリル酸のCOOH基のOHと、エタノールのOH基のHから水分子がとれてエステル結合ができます。
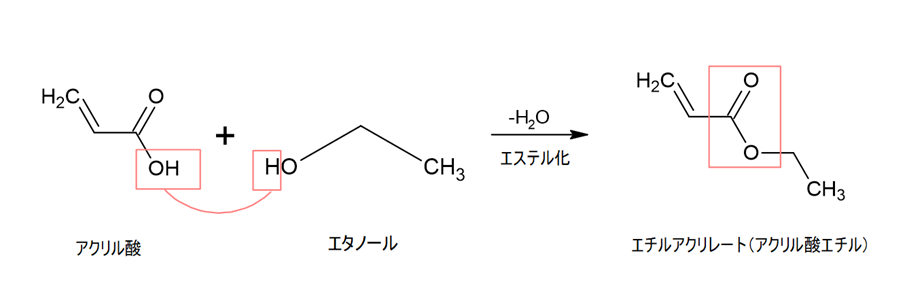
このエチルアクリレートにアクリル酸が付加重合してメタクリル酸とエチルアクリレートのコポリマーができます。
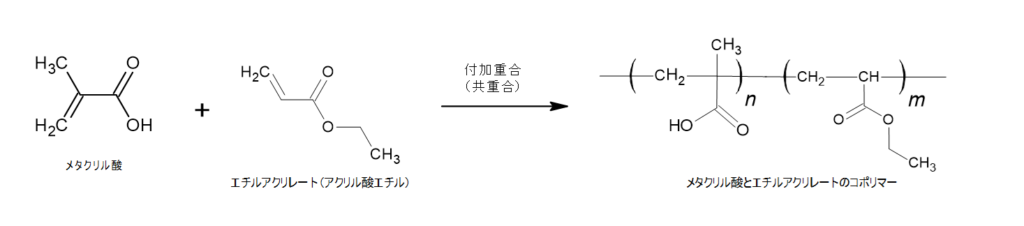
このポリマー分子が同士はそのままでは水素結合によって分子間の結びつきができて大きな塊を作りやすい状態です。
このままでは被覆層を作る際にポリマー分子を均一に分散させることができません。
鮭のムニエルを作るときに表面に小麦粉をまぶそうとしても、ダマがあるとムラができてきれいにつけられないのと同じです。
ここにアルカリ成分を入れるとカルボキシ基と反応してカルボキシ基のHイオンが陽イオンと入れ替わり、分子間の水素結合が弱まります。
よって、分子同士がくっつきにくくなって分散性が向上し、均一な層をつくることができるというわけです。
タルクの滑沢剤としての役割
滑沢剤については前回の記事でもごく簡単に触れましたが、
錠剤の原料となる粉末や顆粒に少量を加えることで、粉体同士の付着力を弱めて粉体の流動性を増すものです。
例えば、打錠プロセスで粉体が臼や杵に付着するのを防ぐなどの効果があります。
タルクは滑石という鉱石(下の写真)を微粉砕して精製した白色粉末で、含水ケイ酸マグネシウム(Mg3Si4O10(OH)2)を主成分とします。

ベビーパウダーの主原料でもあるので、肌をさらさらに保つ効果から滑沢剤のイメージにつながりやすいと思います。
なぜ付着力を弱める性質があるのかというと、タルクの構造にポイントがあります。
タルクは下図のように、Si-O四面体が二次元に連続したシートと、Mg-OHの八面体が二次元に連続したシートとが、2:1で重なりあった層構造をしています。
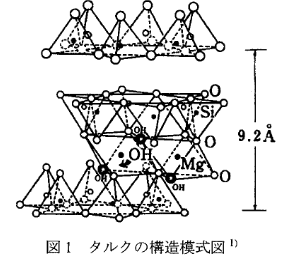
この層構造から、グラファイトがグラフェンシートの層が重なりあってできていたことが想起されます。
グラファイトの場合はグラフェンシート同士が弱いファンデルワールス力で結びついていたため、層同士がはがれやすく、そのため鉛筆の芯や潤滑油として用いられるのでした。
タルクの場合も同様で、層間は酸素同士の面が向き合っており非常に弱いファンデルワールス力で結びついているため、もろくはがれやすいのです。
このような層間の滑りやすさにより、被覆層に添加することで付着力を弱める効果を発揮します。
特許の新規性
従来の1-[2-(2,4-ジメチルフェニルスルファニル)フェニル]ピペラジンまたはその塩を有効成分とする腸溶性錠剤と今回の特許の大きな違いは次の2点です。
①アルカリ成分を実質的に含まない
②従来推奨されてきたポリマー成分に対するタルク重量比(50%)よりも少ない重量比である(40%以下、より好ましくは10~25%)
①について、なぜアルカリ成分を実質的に含まないようにしたかというと、胃で溶けずに腸で溶けることを確実にして薬剤の効果を高めるためです。
pH1~2の強酸条件だけではなくpH4.5程度の非常に弱い酸性条件でも成分が溶出せず、腸に到達したときに初めて成分が溶出するようにするという意味です。
なぜアルカリ成分を含まないと、そのようなことが可能になるのでしょうか?
アルカリ成分を加えた場合を考えてみましょう。
上で見たようなメタクリル酸とエチルアクリレートのコポリマーにはカルボキシ基(ーCOOH)があります。
そこに例えばNaを含むアルカリ成分を加えると、COONaのような塩になります。
この状態で強い酸性溶液に入れると、弱酸であるカルボン酸が遊離して元のCOOHになるため、被覆層は溶解しにくくなります。
しかし、カルボン酸よりも弱い酸性条件下になると、COONaがCOO–とNa+のイオンに分離するため、溶解してしまいます。
よって、アルカリ成分を含んでいる場合、通常は胃で溶けることはありませんが、食事の条件で胃の酸性度が低くなった場合に胃で溶けてしまったり、胃と腸の間で溶け始めてしまったりする恐れがあります。
そこでアルカリ成分を加えないようにすれば、カルボン酸は弱い酸性条件下でも溶けることなく、腸に届いて初めてイオンとなって溶けることになり、有効成分を確実に腸で放出できます。
また②は、①と非常に関係があります。
従来技術でアルカリ成分が何のために加えられていたかというと、上で見てきたようにポリマーの分散性を高めて均一な層を形成するためでした。
そのため①を満たした錠剤を実現するには、ポリマーの分散性を高める代わりの方法を見つける必要があります。
その方法が、②のタルク重量比を少なくする、というものです。
タルクは上で確認した通り、滑沢性を持たせるために加えられています。
しかし、タルクを加えすぎると、今度はタルク自体が均一に分散しづらくなって沈降してしまいます。
そこでタルクの滑沢剤としての機能を発揮させつつ、良好な分散をかなえるためにタルクの分量を調整したところ、
ポリマー成分に対するタルク重量比を40%以下、より好ましくは10~25%することで条件を満たせると分かったということです。
製造プロセスについての説明
【0009】から【0036】にかけては製造プロセスの説明があります。
製造方法や添加剤は慣用されているものでかまわないということなので、事前に調べた製造プロセスの流れに沿って理解できそうです。
下図に流れを整理してみました。
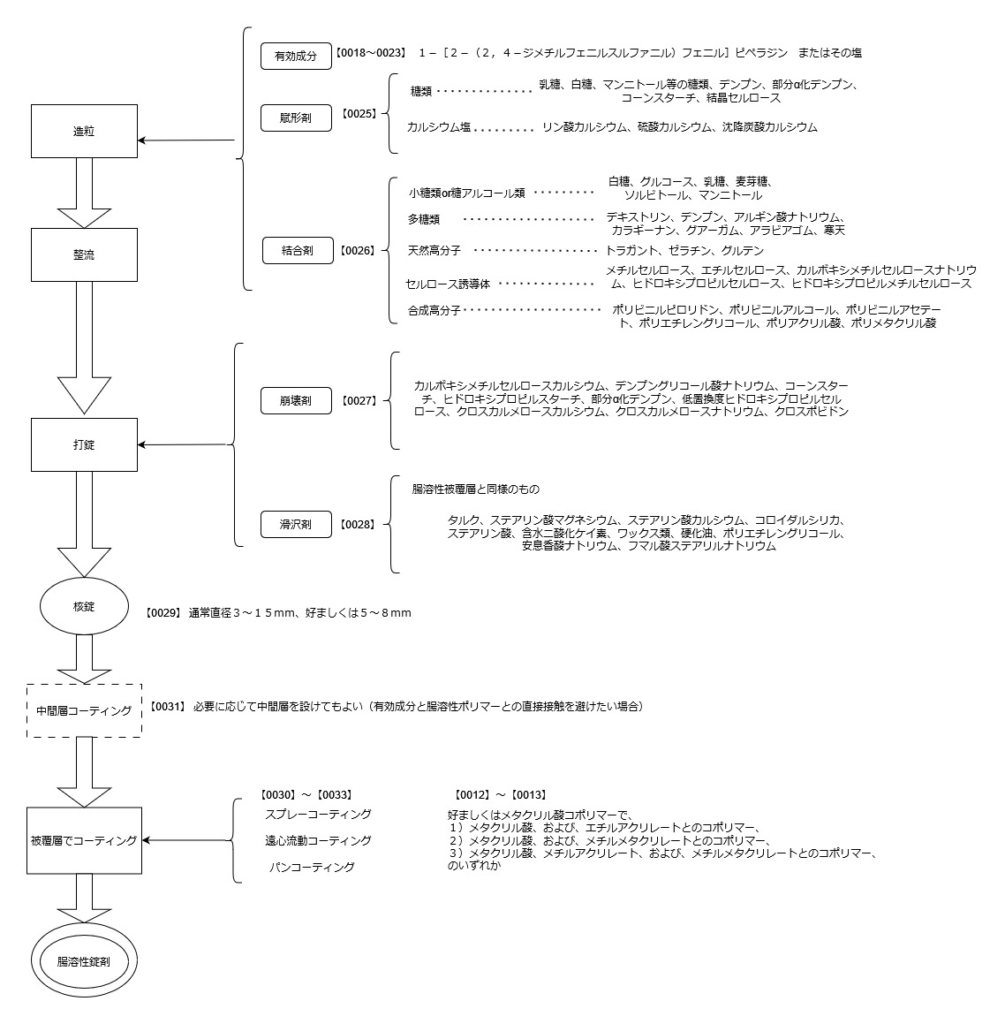
大まかな流れは理解できましたが、物質名が列挙されている箇所はグループ化した整理ができていません。
ひとつひとつの物質を調べて、どういった特徴をもつ物質が例示されているのか確認するのを次の課題にします。
実施例
【0038】~【0063】までは実施例です。
【0038】~【0046】でタルク量を変化させた腸溶性コーティング液を用意して、それぞれの分散性を確認しています。
パターンは3種類あります。
腸溶性被覆基材1:タルク25重量%
腸溶性被覆基材2:タルク25重量%(基材1と組成はほぼ同じだが、コーティング液の総量を約4.5倍に増量)
腸溶性被覆基材3:タルク40重量%(タルク重量を増やし、それ以外の組成は基材2と同じ)
分散性については沈降の有無を目視で確認し、
基材1と2は沈降が見られず分散性が良好である、
基材3は沈降も見られず、1と2に比べてやや劣るものの、実用に耐えうる、と判断しています。
また、後に比較例として腸溶性被覆基材4:タルク50重量%のコーティング液が示されており、タルクの沈降が顕著であったとされています。
従来推奨されていたタルク重量は50%であったことから、この比較例と合わせて、タルク量を減らすことにより分散性が高められるということを示しています。
【0047】~【0054】では核錠の重量違いのものを4種類用意しています。
有効成分である1-[2-(2,4-ジメチルフェニルスルファニル)フェニル]ピペラジン(またはその塩)の含有量と、主に薬剤の大きさを増すために使われる賦形剤であるマンニトールの量だけを変えて、他の成分の種類・量は同じにしています。
核錠の重量は、5mg、10mg、15mg、20mgの4種類です。
【0055】~【0061】では、以上の腸溶性被覆基材と核錠から成る腸溶性錠剤のパターンを7種類用意して実施例1~7としています。
実施例1~7まで、腸溶性被覆基材はすべて基材2に統一されています。
実施例7だけは核錠と腸溶性被覆層との間に中間層を設けたものです。
試験例
タルクを減らすことによる被覆層の分散性向上は実施例で確認できましたが、アルカリ成分を不使用にすることで腸溶性錠剤としての効果を発揮するというのがこの特許のより本質的な部分です。
そのため、実施例1~7それぞれについて、胃では溶けずに腸で初めて溶けるという腸溶性錠剤としての機能を満たすか崩壊試験を実施します。
【0064】~【0071】に試験方法と結果が示されています。
試験方法は、
まず胃を想定した酸性条件下で十分に耐性をもつことを確認したのち、
今度は腸を想定した中性~弱酸性の条件下できちんと錠剤が崩壊して有効成分が溶出するかを確認する、
という方法で行われます。
前者の耐酸試験は0.1N塩酸またはpH4.5酢酸緩衝液、後者ではpH6.8りん酸緩衝液が使用されます。
ちなみに1.0N塩酸のNは規定度といい、モル濃度に酸・アルカリの価数をかけた濃度です。
塩酸は1価の酸なので、1.0N=1.0mol/Lとみなせます。
前回の記事で確認した日本薬局方の崩壊試験法には酢酸緩衝液での試験は規定されていませんが、通常の胃の強い酸性条件を想定した1.0N塩酸だけでなく酸性度の低い酢酸緩衝液でも試験をすることにより、比較的弱い酸性条件でも錠剤の有効成分が溶けださず腸に届いて初めて作用するという本特許の核心部分を証明する狙いがあります。
実施例とそれぞれの試験結果は表のようになります。
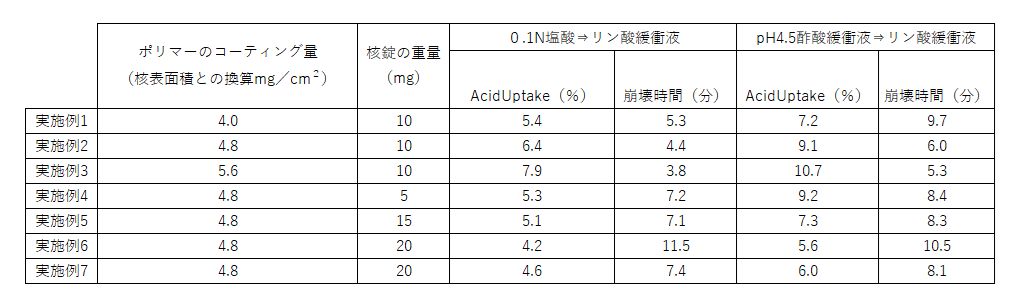
AcidUptakeは最初の耐酸試験の結果を表しており、崩壊時間は後半の腸を想定した環境での試験結果を表しています。
耐酸試験のAcidUptakeという指標は、次の式で求められます。
AcidUptake(%)=(試験後の錠剤重量-試験前の錠剤重量)/試験前の錠剤重量 ×100
つまり、試験前後で錠剤の重量がどれくらい増加したかという増加率をパーセンテージで示したものです。
酸性条件下で錠剤の重量が増えたということは、錠剤の中に酸性溶液が取り込まれたことを意味し、酸性環境下でコーティングが膨潤して崩壊することにつながります。
よって、耐酸性を確認するうえではこの値が小さい方が良く、具体的には10%以下であれば極端な膨潤は生じていないとみなせます。
結果の表を見ると、実施例3のみ、酢酸緩衝液でのAcidUptakeが10%を超えていますが、他はすべて10%以下に収まっています。
実施例3も酢酸緩衝液ではやや基準を上回りましたが、塩酸での試験は基準を満たしています。
リン酸緩衝液での試験結果に関して明細書には特に基準が書かれていませんが、日本薬局方の崩壊試験法に基づいているため、その基準で考えればよいと思われます。
上下振動する装置の中に試験液とともに錠剤を入れ、60分後に何個崩壊したかで判断します。
最初は6個をそれぞれ別のガラス管に入れて試験を行い、6個すべて崩壊すれば合格です。
1~2個崩壊しないものがあった場合は、さらに12個について同様に試験を行い、計18個のうち16個以上が崩壊すれば合格です。
崩壊時間を計測できる装置の場合はすべてが崩壊した時間を計測するということになっているので、この特許で示されている崩壊時間は試験対象の錠剤すべてが崩壊した時間ということかと思います。
これに関してはいずれの実施例も既定の60分よりはるかに短い時間で崩壊しているため、十分に基準をクリアしているとみられます。
このようにして、
「タルクの使用量を軽減し、アルカリ成分を配合しないことを特徴とする、腸内到達後に速やかに崩壊し有効成分が溶出される、生体内利用率が向上した腸溶性錠剤」
が実現されました。
参照)
・稲垣香那、駒城素子「タルクの構造と特性」生活工学研究, Vol.8, No.1, 2006
・富士フイルム和光純薬㈱ ”試薬・化学の基礎知識” https://labchem-wako.fujifilm.com/jp/question/013355.html (参照2024-08-08)
8/6(火)学習時間:4.5H
・岡野の化学(191)
・腸溶性錠剤に関する特許(途中まで)
その他)
・3596 高校化学と化学系特許翻訳
8/7(水)学習時間:5.5H
・岡野の化学(192)
・腸溶性錠剤に関する特許(最後まで)
・タルクについて
その他)
・2683 受講生ブログへのコメント
8/8(木)学習時間:7.5H
・岡野の化学(193)
・腸溶性錠剤に関する特許のまとめ
・酸付加塩について
その他)
・3143 CV見直し術
課題)
・腸溶性錠剤に関する特許明細書に出てきた化合物を調べ切れていないので続き
・腸溶性のカプセル剤に関する特許を読む








コメントを残す