岡野の化学でコロイドの電気泳動について学習したので、電気泳動の種類にどのようなものがあるか調べたところを書いてみます。
電気泳動とは
電解質溶液中に帯電したコロイド粒子を分散させ、外部から電圧を印加すると、コロイド粒子は自身の電荷と異なる電荷の方向に向かって移動します。
これが電気泳動という現象です。
電気泳動の際の移動度(移動の距離・速度)は、コロイド粒子の分子量や電荷によって異なるため、移動度の違いから物質を分離・分析でき、主にタンパク質やDNAの分析手法として用いられています。
電気泳動にはいくつかの種類があるので、以下に見ていきます。
ゾーン電気泳動
支持体の一端から試料を注入し(通常はプラス極側)、両端に電圧をかけることで、試料の移動度の大きい順に帯状に分離する方法です。
支持体とは、電解質溶液や粒子を支える物体、という意味で、ろ紙や寒天など色々な種類があります。
支持体を用いることで、分子が拡散するのを防ぎ、試料中の各成分を安定した帯状のバンド(下図)として得られます。
バンドは、試料に色素や蛍光染料を加えることで可視化されます。
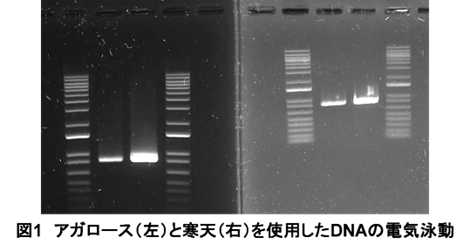
ゾーン電気泳動にも分離装置や支持体によっていくつかの種類があります。
代表的なものを以下に見ていきます。
キャピラリー電気泳動
キャピラリーと呼ばれる装置を使う方法です。
キャピラリーとは、中空細管の内面に、液相や吸着剤を塗布、または化学結合させたものです。
電気泳動で一般的に使われるものは、内面にフューズドシリカとよばれる溶融シリカを化学結合させた中空間を使用します。
この中に緩衝液を満たして試料を泳動させます。
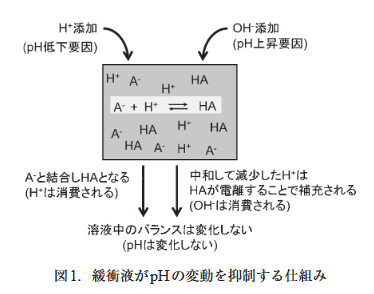
緩衝液とは、酸・塩基の添加や溶液の希釈、温度変化といった外部要因から生じるpHの変化を和らげる作用をもつ溶液のことで、バッファーとも呼ばれます。
弱酸とその共役塩基、または弱塩基とその共役酸を混合したものです。
弱酸や弱塩基はその一部が電離して平衡状態が保たれているので、
外部からH+が増えた場合は緩衝液のA–(共役塩基)がH+と結合してHA(酸)を作り、OH–が増えたらHAがH+とA–に電離することにより、溶液中のpHを一定の状態に保てます。
さて、フューズドシリカを用いたキャピラリーカラムでは、内面のシリカが下図のようにSi-OHがSi-O-に電離して負に帯電しています。
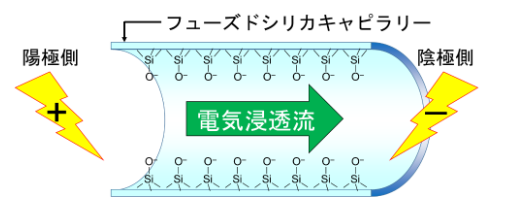
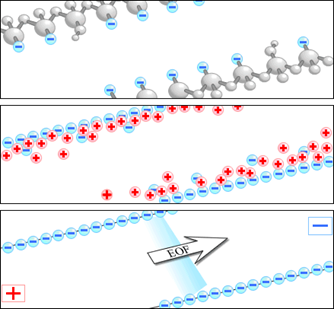
すると電荷のバランスを整えるために緩衝液中の対イオン(主に陽イオン)が内壁表面に引き寄せられて電気二重層を形成します。
そこにキャピラリーの両端に電圧を印加すると、二重層を形成している陽イオンが陰極側に向かって流れます。
このようにして発生するキャピラリー内の液全体の流れを電気浸透流(EOF)と言います。
電気浸透流は通常、試料の泳動速度よりも速いため、試料は帯電する電荷の正負に関係なく、すべて陰極側で検出できます。
ゲルを支持体とした電気泳動
次は支持体に着目して、ゲルを支持体とした電気泳動を見てみましょう。
ゲルを支持体とした場合の基本原理はふるいのようなもので、ゲルの網目をすり抜けやすい小さな分子は移動度が大きく、大きな分子は移動度が小さくなるため、その差を利用して分離するというものです。
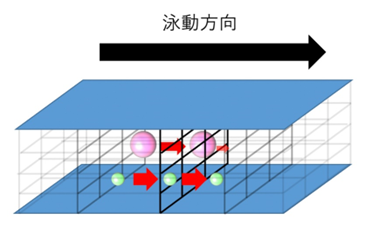
ゲルを支持体とした電気泳動には、主にポリアクリルアミドゲル電気泳動(PAGE)とアガロースゲル電気泳動の2種類があります。
両者の大きな違いは分離の対象で、ポリアクリルアミドゲル電気泳動はタンパク質、アガロースゲル電気泳動はDNAやRNAの分離に使われます。
ポリアクリルアミドゲル電気泳動
ポリアクリルアミドゲルというゲルを支持体とする方法です。
ポリアクリルアミドは、アクリルアミドをラジカル付加重合することでできるポリマーで、ポリアクリルアミドゲルはそれがさらに網目構造になり、水などの媒体を吸収して膨潤したゲル状のものを言います。
ポリアクリルアミドゲルの製法は下図のようになります。
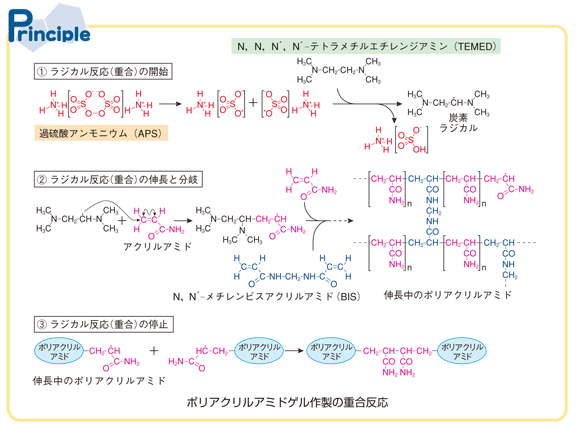
過硫酸アンモニウム(APS)とN, N, N’, N’ – テトラメチルエチレンジアミン( TEMED)がラジカル重合剤として用いられます。
APSの不安定なO-O部分が水溶液中で開裂してフリーラジカル(不対電子をもつ原子や分子)ができると、これがTEMED中の水素を引き抜き、今度はTEMED中に炭素ラジカルができます。
このTEMED中の炭素ラジカルが重合開始剤となってアクリルアミドと反応することで重合が開始します。
アクリルアミドの他にN, N’ – メチレンビスアクリルアミド(BIS)を添加することによって、BISがポリアクリルアミドの鎖を架橋する役割を果たし、三次元の網目構造が出来てゲルになるのです。
この網目を試料が通過することで、分子量による分離が行われます。
ポリアクリルアミドゲルを支持体とする中でも、よく用いられる方法にSDS-PAGEと呼ばれる方法があります。
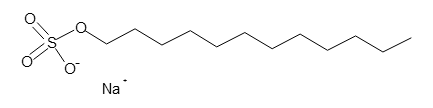
これは、還元剤を加えてタンパク質のS-S結合を切断したところに、陰イオン性界面活性剤であるSDS(ドデシル硫酸ナトリウム)を加えてタンパク質に結合させることで、タンパク質を一様に負に帯電した直鎖状の構造にする方法です。
これによって様々な試料を電荷の違いによらず、分子量に依存して分離することが可能になります。
アガロースゲル電気泳動
アガロースは海藻から取れる多糖類です。
アガロースの粉末にTAE緩衝液(トリス(Tris)、酢酸(Acetate)、エチレンジアミン四酢酸(EDTA)からなる緩衝液)を加えて温めることでゲル状にすることができます。
DNAやRNAを分析対象とする場合にはSDS-PAGEのようにSDSを加える必要はありません。
核酸を構成するリン酸基によって、必ず負の電荷を帯びているためです。そのため、核酸は陰極側から陽極側へと移動します。
アガロースゲルはポリアクリルアミドゲルと比べると大きな孔をもつ網目構造になっています。
理由は分析対象のサイズの違いです。DNAとタンパク質ではサイズが大きく異なります。
一般的なタンパク質は数nm~数十nmの範囲ですが、DNAは小さなものでも数百nm、染色体DNAになると数cmにもなります。
この大きな差が、アガロースゲルとポリアクリルアミドゲルの使い分けの理由の一つとなっています。
次にゲージ電気泳動以外の分離原理も見てみましょう。
等電点電気泳動
試料の等電点の違いを利用して分離する方法です。
これはタンパク質の分離に使われる方法です。
等電点とは、タンパク質やタンパク質を構成するアミノ酸の電荷の総和がゼロになるpHの値をいいます。
アミノ酸はアミノ基(-NH2)とカルボキシル基(-COOH)の両方を持っています。
カルボキシル基は水中でH+を放出してCOO–になるため酸性を示します。つまり負の電荷を持ちます。
アミノ基はNが結合に関与しない非共有電子対(ローンペア)を持っているために、水中のH+に電子を供与してルイス塩基として働き、
-NH3+になります。つまり正の電荷を持ちます。
このように一つの分子内に正電荷と負電荷の両方の性質を持つ分子を双性イオンといいます。
双性イオンは周囲のpHによって電荷が下図のように変化します。
pHが小さい、つまり酸性条件下ではアミノ基がNH3+になって正電荷を示します。
逆にpHが大きい、つまり塩基性条件下ではカルボキシル基が-COO–になって負電荷を示します。

この図はアミノ基とカルボキシル基が1つずつの単純な例なので中性条件下で等電荷となっていますが、
タンパク質によってアミノ基とカルボキシル基の数が異なり、中性条件下で最初から正電荷に偏っているものもあれば、負電荷に偏っているものもあります。
そのため、個々のタンパク質によって分子全体の電荷がゼロになるpHは異なるのです。
この性質を利用してタンパク質を分離するのが等電点電気泳動です。
なぜ核酸の分離に使われないかというと、アガロースゲルにSDSを加えない理由と同じです。
DNAやRNAは構成要素のリン酸基の影響でpHに関わらず常に負の電荷を持ちます。
そのため、電荷がゼロになる等電点が存在しないのです。
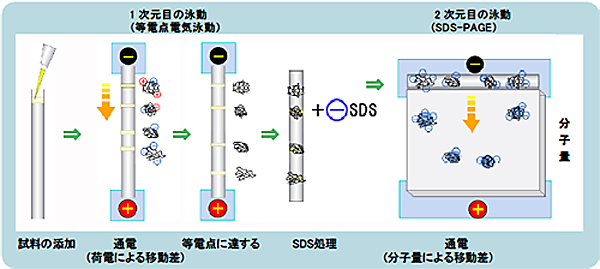
二次元電気泳動
先に見た2つはそれぞれ1つのパラメータによって分離しましたが、パラメータが2つになる場合が二次元電気泳動です。
はじめに1つのパラメータで試料を分離して、次に2つ目のパラメータで分離するという二段階で行う方法です。
多くの場合は1次元目に等電点電気泳動で分離を行い、次に分子量での分離を行います。
等電点によって試料を分離した後、同じ等電点の試料をさらに分子量の違いによって分離できるため、より精密な分析が可能になります。
電気泳動の利用
電気泳動による分離は次のようなところで使われています。
・タンパク質の分子量測定
分子量既知のタンパク質と分子量未知のタンパク質それぞれについてバンド位置から移動度を計算することで、近似する値を分子量未知のタンパク質の分子量として算出できます。
・遺伝子組み換え実験
遺伝子組み換えを行って部分的に挿入や欠損を生じさせた場合は、DNAの長さが変わるため、きちんと挿入・欠損が行われたかどうかを電気泳動によって分子量の大きさで分離して確認できます。
・DNA鑑定
またDNA鑑定にも電気泳動を利用することが可能です。サンプルとなるDNAが分かっていれば、それと同じように泳動するかどうかでDNAの一致を確認できます。
7/25(木)学習時間:5H
・岡野の化学(173)途中まで
・電気泳動について
課題)
・電気泳動に関する特許を確認する
・ゾル―ゲル転移とその利用について調べる
・写真フィルムの原理について整理できていないので続き








コメントを残す