前回の投稿でるつぼは素材と特性によって使われる場面が異なるということを調べていましたが、なぜその素材がその特性をもつのか、ということを考えるのに結合のしくみがしっかりわかっていないと難しいと感じました。
ちょうど岡野の化学の内容が理論化学に入ったのでじっくり取り組みたいと思います。
昨日は岡野の化学(88)で第一イオン化エネルギーについて学習したので、
第一イオン化エネルギーのグラフと周期表のグループ分けを対比させて、なぜこのようなグラフになるのかを考えてみました。
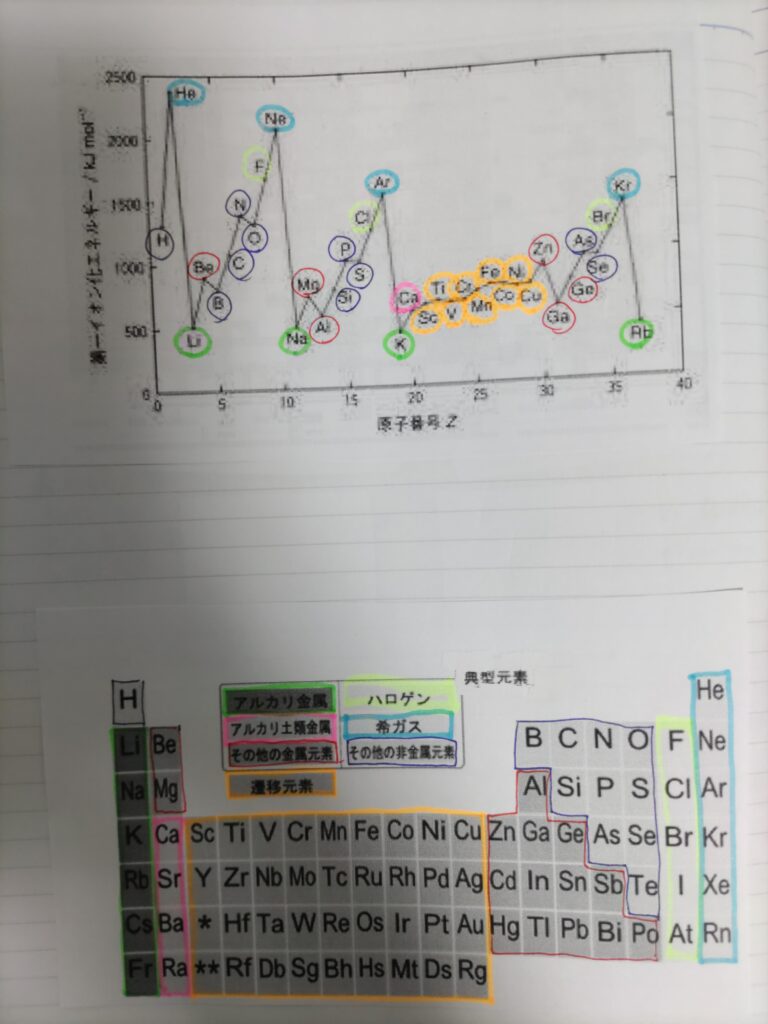
第一イオン化エネルギーは原子やイオンから電子を1つ取り去るときに必要となるエネルギーです。
全体として、同一周期の元素の中では、原子番号が大きくなるほどイオン化エネルギーが大きくなる傾向があります。
まず、希ガスは最外殻が満たされていて最も安定した状態のため、そこから電子を取り去るのは難しく、イオン化エネルギーは大きくなります。
アルカリ金属は逆に最外殻にひとつだけ電子があるのでこれを取ってしまえば希ガスと同じ安定した電子配置になるということでイオン化エネルギーは一番小さくなります。
そのほかの元素は最外殻の電子配置がアルカリ金属から希ガスに近づくにつれてイオン化エネルギーが大きくなると考えられます。
また同じ族の中では周期が下に行くにしたがって第一イオン化エネルギーが小さくなります。
これは周期が下に行くと原子の半径が大きくなって電子と陽子の距離が離れていき、それにつれて電子が陽子に束縛される力が小さくなるため、電子が外に出ていきやすくなるということでした。
先ほど同一周期の元素の中では、原子番号が大きくなるほどイオン化エネルギーが大きくなる傾向があると書きましたが、逆転が起きている箇所もあります。
例えば、BeとB、NとO、MgとAlなどです。
これは閉殻と半閉殻の状態が安定するという理由で説明できます。
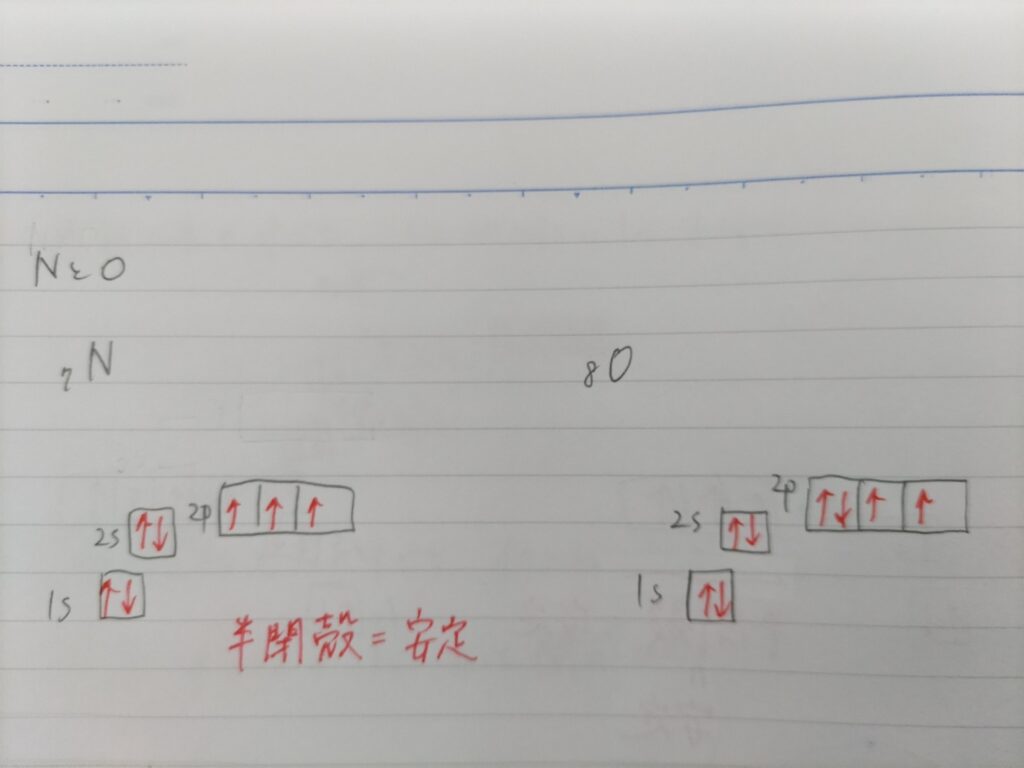
BeとB、MgとAlについて電子の軌道への入り方を確認するとこのようになっています。
Be、Mgはどちらも軌道が電子2個のペアで満たされていて安定した状態になっているため、イオン化エネルギーが大きくなります。

NとOの場合は、Nの2p軌道すべてに1つずつ電子が入っている半閉殻の状態になっています。
電子が一つの軌道に一つずつ入った状態だと電子同士の反発が少なく安定した状態になるため、半閉殻の状態も安定しています。よってNの方がOよりもイオン化エネルギーが大きくなります。
ここまでは講義ビデオで学習した内容の復習でしたが、問題は遷移元素がほぼ横ばいで並んでいる理由です。
遷移元素の中でもMnなどは3d軌道が半閉殻になっているのになぜ他とそんなに差がないのでしょうか?
これは考えてもよくわからなかったので調べてみました。
すると、これに関係しそうなケムステの記事と福井大学の講義資料をみつけました。
「【誤解してない?】4s軌道はいつも3d軌道より低いわけではない」
「福井大学の講義資料」
電子が軌道へ入る順番はエネルギーの低い4sから先に入り、その次に3dに入ると学びましたが遷移元素の場合は3d軌道よりも4s軌道の方がエネルギーが高くなる場合があるようで、その場合はイオン化する際に4s軌道の方から電子が取り去られます。
ScからCuまでの遷移元素は3d軌道への電子の入り方は変わりますが4s軌道はすべて同じであるため、イオン化エネルギーがほぼ横並びになっているようです。
このようなs軌道とd軌道のエネルギーの変化が遷移元素が多様な価数をとったりすることができる理由のようです。
5/23(木)学習時間:5.5H
・岡野の化学(87)~(88)
・イオン化エネルギーのグラフについて
・アルミナがセラミックスの一種とわかったので、セラミックスの特性と金属や有機材料の特性の違いについて資料を読んだ
課題)
遷移元素のs軌道とd軌道のエネルギー準位の変化の理由はよく理解できなかったのでもうケムステの記事などを読みかえしてみて、それでも難しいようなら知子の情報に入れる。
その他
・調べたいことが増えてきてつい就寝時間が遅くなりがちなので生活リズムを見直す。








コメントを残す