岡野の化学で化学平衡や反応速度について学習したのでまとめます。
化学反応が起きるとき
そもそも化学反応が起きるときにはどのようなことが起きているのでしょうか。
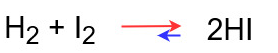
H2とI2からHIができる以下の反応を例に見ていきます。
H2 + I2 → 2HI
ある状態から別の状態に変化する化学変化が起きるときに必要な最小限のエネルギーを活性化エネルギーといいます。
水素とヨウ素の例でいうと、元のH分子とI分子のそれぞれの結合が切れやすい状態にするために外部からエネルギーを与える必要があります。
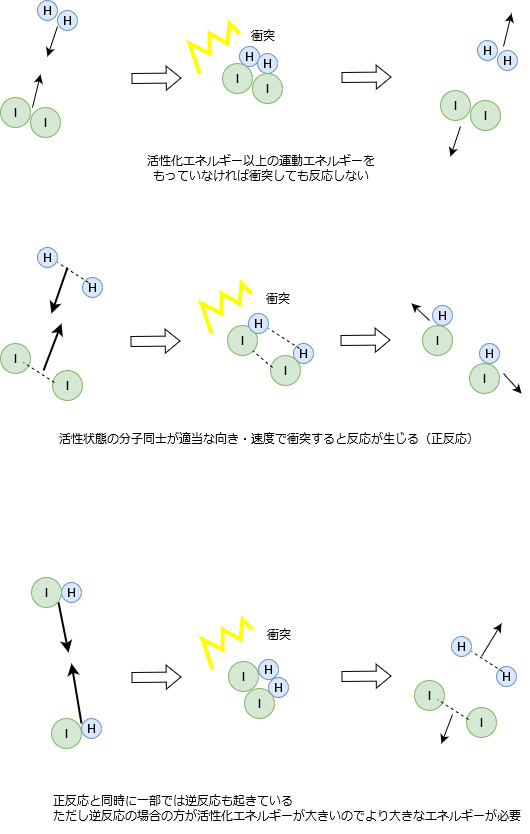
外部からエネルギーを与えられて活性化エネルギー以上の運動をもった粒子同士が衝突することにより、反応が生じます。
この活性化エネルギーを小さく抑えて反応が起こりやすくするのが触媒の作用です。
下図はH2 + I2 → 2HIへの反応(正反応)が進む際のエネルギーを表したグラフです。
グラフの真ん中の山を越えないと反応は進みません。
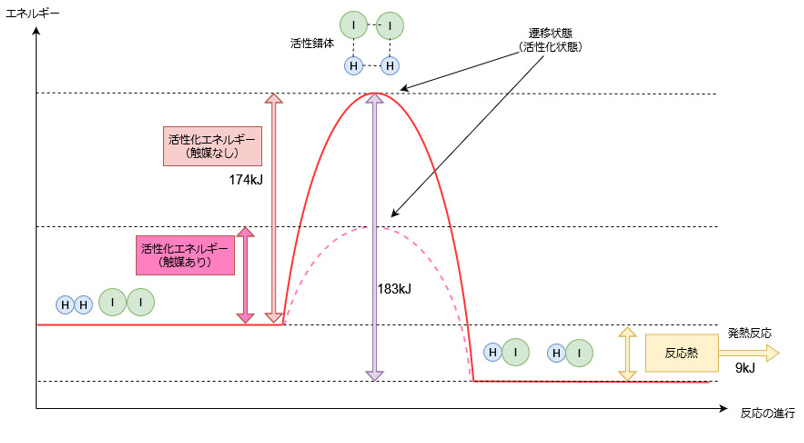
図のピンクの点線で書いた部分は触媒の作用で山が小さくなって越えやすくなっています。
これは反応に必要な活性化エネルギーが小さくなったことを表します。
触媒の作用がなければ174kJの活性化エネルギーが必要になります。
触媒は活性化エネルギーを小さくしますが、図からも分かるように反応熱はには影響を与えません。
先ほど、活性化エネルギー以上のエネルギーで衝突すると反応が起きると書きましたが、
厳密にはそれだけでは反応が起こるとは言えません。
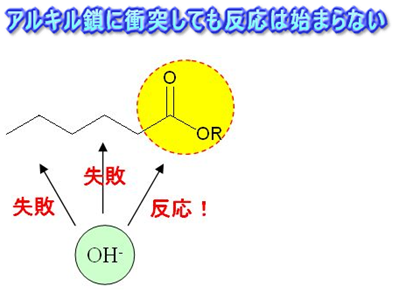
反応が起きるには下図の例のように衝突するときの向きも関係しています。
そこで反応物を適切な配列に整えて反応させやすくするのも触媒の役割です。
さて、先ほどのエネルギー図をみると、
水素とヨウ素からヨウ化水素を生成する反応では、反応前のエネルギーより反応後のエネルギーの方がエネルギーが低くなっていることが分かります。
このような場合は反応によって元の物質より安定した生成物ができるため、余分なエネルギーが放出されて発熱反応となります。
先ほどのエネルギー図は正反応の図ですが、実際にはこれと同時に逆向きの反応(逆反応)も起こっています。
逆反応は正反応の矢印を逆にした反応になります。
H2 + I2 ← 2HI
逆反応の進行は先ほどのグラフの横軸を反対側から読んでいけばよいということになります。
この反応では正反応が発熱反応なので、逆反応では吸熱反応になります。
そのため逆反応の場合は、正反応が起こるのに必要とした活性化エネルギーに加え、さらに反応熱の分のエネルギーを外部から与える必要があります。
つまり、逆反応の場合の活性化エネルギーは、
正反応の活性化エネルギー+反応熱
ということになります。
先ほどの図で見ると紫色の矢印で表した部分に対応するエネルギーが必要になります。
反応に必要なエネルギーが大きいほど反応は起こりにくくなるので、
活性化エネルギーが大きい逆反応は正反応よりも起こりにくいと言えます。
そのため系全体の反応としては正反応の方向に進むと言えます。
H2 + I2 → 2HI
水素とヨウ素の反応についてまとめると次のようになります。
反応速度を上げるには
反応速度を上げるために、触媒を用いる以外にどのような方法が考えられるでしょうか。
反応速度を左右するパラメーターとして次の2つが挙げられます。
・温度
・濃度
それぞれが関係する理由を以下に見ていきます。
温度と反応速度
反応が生じるためには反応物が活性化エネルギー以上の運動エネルギーを持っている必要があります。
そのため、温度を上げて活性化エネルギー以上のエネルギーを持った粒子を増やすことで、それらの粒子が衝突して反応速度が高まります。
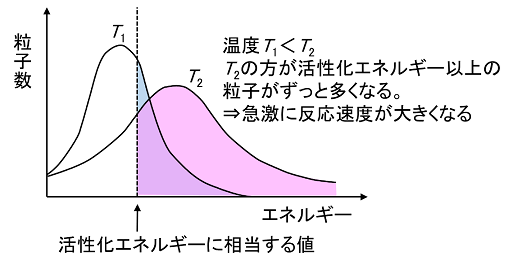
下図は低温の場合と高温の場合の、エネルギーと粒子数の関係を表しています。
T1が低温の場合、T2が高温の場合です。
それぞれ活性化エネルギーに相当する値の線より右側の部分の面積が活性化状態の粒子の数を表します。
温度が高いT2の方が活性化状態の粒子が多くなっていることが分かります。
濃度と反応速度
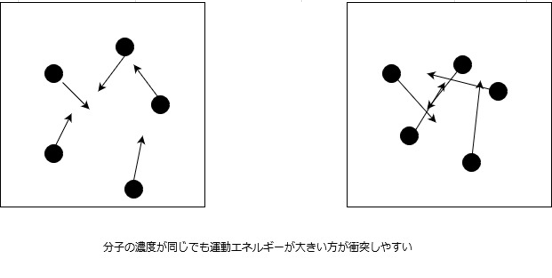
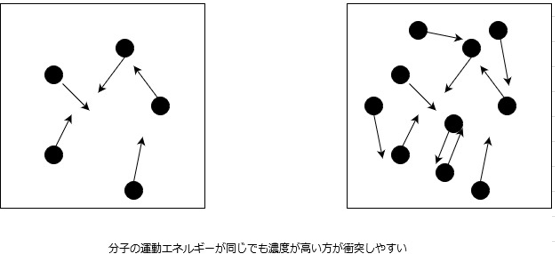
運動エネルギーが同じだった場合でも、ある決まった体積の中に含まれる粒子の数が多ければそれだけ衝突する確率が上がるため、反応が起こりやすくなります。
例えば、以下の一般式で表せる反応式があった場合、
aA + bB → cC + dD
平衡状態での反応速度νについて次の式が成り立ちます。(平衡状態については後述)
ν=k[A]a[B]b (kは反応速度定数)
[A]と[B]はそれぞれ反応物AとBのモル濃度(単位:mol/L)です。
なぜAとBの濃度の掛け算で表されるのかを具体的に考えてみましょう。
物質AとBが1個ずつ存在するとき、AとBが衝突する回数は1です。
Aが1個、Bが2倍の2個存在するとき、AとBの衝突回数は1×2で、2倍になります。
Aが2倍の2個、Bが2倍の2個存在するとき、AとBの衝突回数は2×2で、4倍になります。
Aが1個、Bが3倍の3個存在するとき、AとBの衝突回数は1×3で、3倍になります。
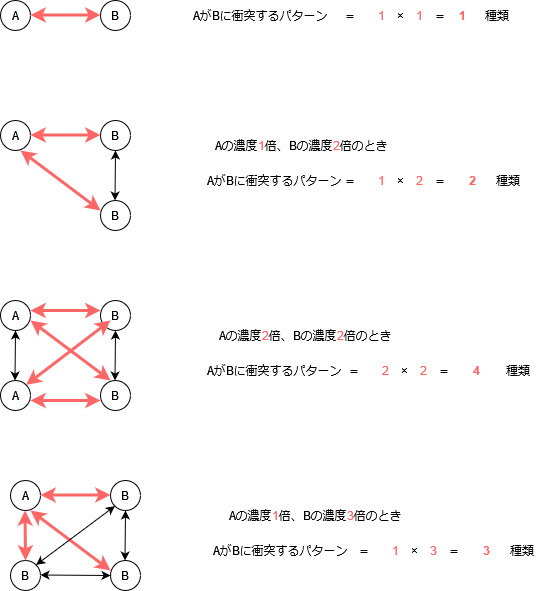
このように、衝突回数は反応物の濃度に比例するのです。
では、濃度が係数のべき乗になっているのはなぜかというと、
1回の反応でその反応物が係数個分だけ同時に衝突する必要があるためです。
例えばAの係数が3、Aのmol数が2molの場合、
Bとの衝突に関与する1個目のAを見つける確率は2molになったため2倍、
Bとの衝突に関与する2個目のAを見つける確率も2倍、
Bとの衝突に関与する3個目のAを見つける確率も2倍、
したがって、2×2×2=2の3乗倍ということになります。
よって[A]a[B]bのように、濃度のべき乗の形で表されるのです。
ただし、このべき乗は実験値を見ると必ずしも反応物の係数に一致しません。
そのような場合の例として多段階反応を次に見ていきます。
多段階反応
先ほどの反応速度の関係式は中間体を含まない一段階の反応(素反応)の場合にはそのまま成り立ちますが、
中間体を経て複数の素反応が段階的に生じる多段階反応の場合にはそのまま当てはめられません。
なぜかというと多段階反応では最も反応速度の遅い律速段階が系全体の反応速度を決定するためです。
レストランでお客さんが席についてから料理を提供するまでを一連の反応として例えてみましょう。
・お客さんから注文をとる、
・食器を用意する、
・食事をつくる、
といった様々なステップがありますが、一番時間がかかるのは料理を作る時間です。
他の工程をいくら速くやるといっても大した差はなく、料理を作るのにかけた時間によって、お客さんが席についてから料理を提供するまでのスピードが決まるのです。
具体的に次の反応式で考えてみます。
3ClO– → ClO3- + 2Cl–
上で見た反応速度の式を使うと
ν=k[ClO-]3 となりそうですが、
実際は
ν=k[ClO–]2 となります。
この反応は多段階反応のため、3ClO– → ClO3- + 2Cl–の反応が直接生じるわけではなく、次の二段階を経ます。
①ClO– + ClO– → ClO2- + Cl–
②ClO2- + ClO– → ClO3- + Cl–
グラフとしては下図のようなふたこぶ型になります。
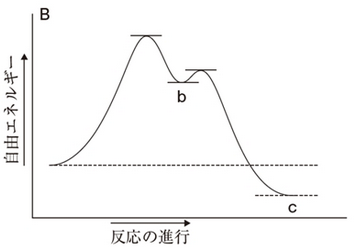
この場合は①の反応ステップが活性化エネルギーが大きく反応速度が最も遅いため、律速段階になります。
そこで律速段階の反応
ClO– + ClO– → ClO2- + Cl–
の影響を受けて、
ν=k[ClO–]2
になったものと考えられます。
反応速度とスペクトルの関係
分析手法の中に分光分析というものがあります。
物質が放射または吸収する光の波長を分析し、分子固有の波長(スペクトル)を見つけることで、物質の成分や特性を分析する手法です。
このスペクトルを分析することで反応速度を求められます。
前回の記事で取り上げたフィルム写真の現像液に使われていたヒドロキノンの例で見てみます。
ヒドロキノンは次のような酸化反応を示します。
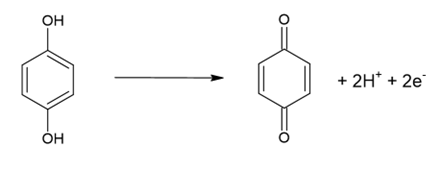
反応が進むと、ベンゼン環の-OH(ヒドロキシ基)が=O(カルボニル基)に変わることが分かります。
例えばNMR分光法でスペクトルを分析すると、スペクトルに現れる官能基ごとの特徴的なピーク位置からサンプルの構造が特定できます。
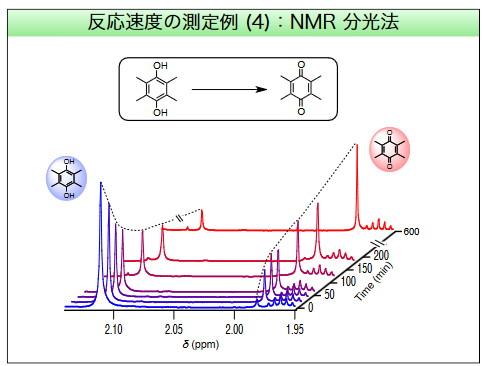
手前から奥に向かって時間が経過していますが、スペクトルのピークが時間経過とともに左側から右側に変化していることが分かります。
これはヒドロキシ基に特有のピークからカルボニル基に特有のピークへと変化していること、つまりヒドロキノンからp-キノンへの化学変化が進んだことを意味します。
このようなスペクトルの変化と経過時間を分析することにより、反応速度を求めることが可能になります。
化学平衡
正反応と逆反応が同時に起こるという話を書きましたが、
正反応と逆反応の反応速度が等しくなり、見かけ上反応が停止したようになっている状態を平衡状態といいます。
化学反応についての平衡状態なので化学平衡と呼ぶこともあります。
「見かけ上」と言っているのは、ミクロの世界では正反応と逆反応がそれぞれ起きているのですが、反応速度が等しいために全体としての反応のバランスは変化しないため、反応が停止しているとみなせるということです。
平衡状態は逆反応が起こることを前提にしています。
逆反応が起こるような反応のことを可逆反応といい、多くの化学反応は可逆反応です。
しかし、逆反応の速度が非常に小さい場合は逆反応が起こらないものとして不可逆反応とみなす場合もあります。
また生成物を系から取り除いてしまえば当然逆反応は起こらなくなります。
すでに見てきたように水素とヨウ素からヨウ化水素を生成する反応は逆反応が生じますので可逆反応です。
反応が始まってから反応が見かけ上停止する平衡状態になるまでに、正反応と逆反応の反応速度は時間とともに下図のように変化します。
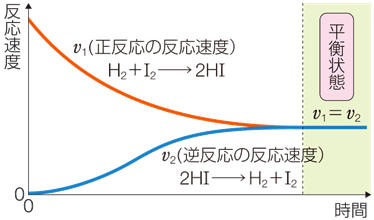
正反応と逆反応の反応速度に差があるときは、反応速度が速い方の矢印を長く、遅い方の矢印を短く書いて表現できます。
①反応が始まった直後
はじめは生成物のHIが存在しないため、最初は正反応のみが起こります。

②反応途中
時間の経過とともに生成物のHIが増えてくると逆反応が起こりやすくなり、逆反応の反応速度が上がります。
逆に反応物の濃度は減っていくので正反応の反応速度は時間の経過とともに小さくなっていきます。
ただし、水素とヨウ素からヨウ化水素を生成する反応では、正反応の方が活性化エネルギーが低く逆反応より起こりやすいため、反応速度は正反応の方が大きいままです。
③反応が終わったとき
やがて正反応と逆反応の速度が等しくなります。
このとき反応が見かけ上停止した平衡状態となります。
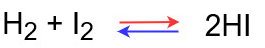
ルシャトリエの原理
平衡状態とは正反応と逆反応のつり合いがとれたバランスのよい状態です。
反応式の左辺と右辺で天秤がつり合った状態をイメージしてみましょう。
もしここで左と右のどちらかが重くなったり軽くなったりしたら、天秤はつり合いがとれなくなってしまいます。
では、左が重くなったときにもとのバランスのとれた状態に戻すにはどうすればいいかというと、反対に右を重くすればいいということになります。
このように、化学平衡がとれている状態のときに平衡を崩すような変化が起きた場合、その変化を妨げるように逆向きの変化が生じてバランスを保とうとする現象が起きます。
これをルシャトリエの原理と呼んでいます。
より正確には、
「化学平衡が成立しているときに温度・圧力・濃度のいずれかを変化させると、それらの変化を妨げる方向に平衡が移動する」
という原理です。
温度・圧力・濃度それぞれについて、窒素と水素からアンモニアを生成する反応を例にとって具体的にみてみましょう。
温度を変化させたとき
平衡状態での反応式は次のようになっています。
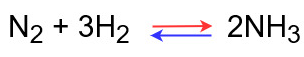
この反応の正反応は発熱反応で、逆反応は吸熱反応になります。
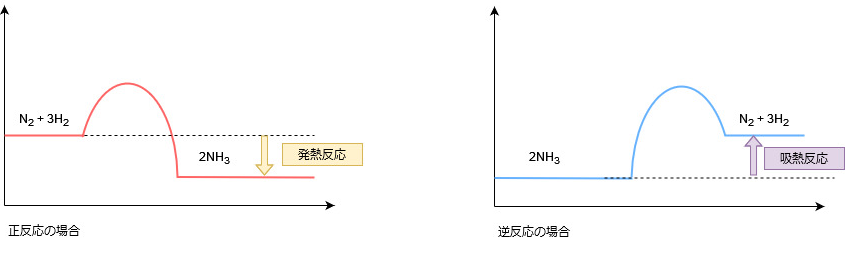
したがって、ルシャトリエの原理に基づき次のことが成り立ちます。
◆温度を上げたとき
温度を下げるために吸熱反応である逆反応が進む
⇒平衡が左に移動する
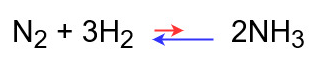
◆温度を下げたとき
温度を上げるために発熱反応である正反応が進む
⇒平衡が右に移動する
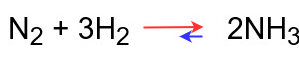
圧力を変化させたとき
体積が一定の場合、分子のモル数が多い方が圧力が高くなります。
反応式の左辺と右辺を見てみると、
左辺はN2が1mol、H2が3molの計4molです。
右辺はNH3が3molです。
つまり、左辺の方がモル数が多く、圧力が高い状態になっています。
よって、
◆圧力を上げたとき
圧力を下げるためにモル数が少なくなる方向に反応が進む
⇒平衡が右に移動する
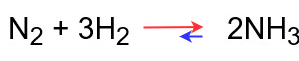
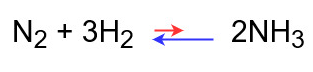
◆圧力を下げたとき
圧力を上げるためにモル数が多くなる方向に反応が進む
⇒平衡が左に移動する
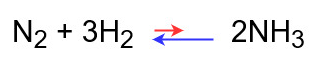
濃度を変化させたとき
アンモニアの濃度を変化させた場合を考えてみましょう。
◆アンモニア濃度を高くした場合
アンモニアの濃度を下げるため、アンモニアを分解する方向に反応が進む
⇒平衡が左に移動する
◆アンモニア濃度を低くした場合
アンモニアの濃度を上げるため、アンモニアを生成する方向に反応が進む
⇒平衡が右に移動する
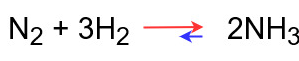
このようなルシャトリエの原理を利用すると、化学工業的にある物質を合成したいときにその反応を進みやすくする工夫をすることが可能になります。
たとえばアンモニアは肥料の原料に使われるので、上記の反応を使ってアンモニアの合成を進めたいと思えば平衡が右に移動するような条件を揃えればよいということになります。
つまり、温度が低く、圧力が高く、生成したアンモニアがすぐ回収できる、という条件を整えればよいのです。
ただし、活性化エネルギーのところで見たように、温度を上げて反応物の運動エネルギーを上げないと反応が進まないというジレンマがあります。
また圧力も高くしすぎると通常の容器では圧力に耐えられないという問題が出てきます。
ただルシャトリエの法則だけにしたがって条件を考えればいいというわけではなく、その他の条件と合わせて最適な条件に調整する必要があるということです。
7/28(日)学習時間:13H
・岡野の化学(177)-(179)
課題)
・反応速度に関して特許明細書での使われ方の確認
・アレニウスプロットについて
その他
・3237 定点観測の重要性
・3175 伝え方の技術










コメントを残す