前々回にゼロ膨張ガラスの話を書きました。
ゼロ膨張ガラスは、熱を加えてもほとんど大きさが変わりません。これは、膨らむ部分となるアモルファス部分と、縮む部分となる結晶部分がうまく混ざっているからです。
今回はガラスのアモルファス構造と結晶構造がどのようにできていくのか、という点について書いてみます。
ガラスのアモルファス構造
ガラス製品として使われている一般的なガラスは、主にSiO2で出来ています。
ガラスは通常、非結晶(アモルファス)の構造をもちます。
結晶は原子や分子が空間的に規則正しく周期的に並んだ構造を持ちますが、アモルファスはこのような規則的な配列を持たずに原子や分子が集合して固まったものです。
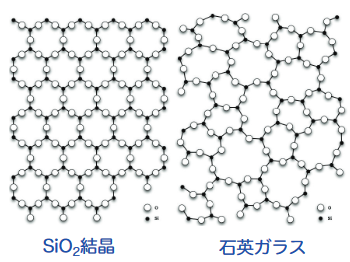
図の左側は結晶構造、右側はアモルファス構造です。
ブロックで例えてみましょう。
どちらもSiO2というブロックを使う点は共通です。
結晶はSiO2のブロックが決まった方向を向いて決まった繰り返しパターンで積み上げて作られた塊ですが、アモルファスはブロックが色々な方向を向いて、ぐちゃぐちゃに積み上げられた塊、というイメージです。
このようなアモルファス構造ができる理由を自由体積という考え方を用いて考えてみます。
自由体積とは
自由体積とは、分子が動き回れる空間のことです。
分子はこの空間で自由に動けます。例えるならお弁当箱のすきまのようなものです。
おかずが占める空間が分子の体積、すきまの部分が自由体積、全体のお弁当箱の容器の体積が物質の体積です。
つまり、物質の体積は、構成する分子そのものが占有する体積と、この自由体積との合計と考えることができ、物質の体積変化は自由体積の変化によって決まると言えます。
自由体積と温度の関係
物質は冷やすと固まり、温めると液体や気体になりますが、これは分子の運動と関係します。
物質を温めると分子の運動は活発になり、分子はバラバラに散らばって、固体から液体、気体へと変化します。
しかし物質を冷やして分子の運動が少なくなると、
クーロン力(プラスとマイナスのイオン同士が引き合う力)や、
ファンデルワールス力(すべての物質に働く、ものとものとをくっつける弱い力。ヤモリが壁にくっつくことができるのも、この力が主要な役割を果たす。)
など、分子同士の間に働く様々な力の影響を受けやすくなります。
このため分子同士は化学的・物理的に結合して固体となります。
下図に体積変化、温度変化、物質の状態変化、の関係を表すグラフを書きました。
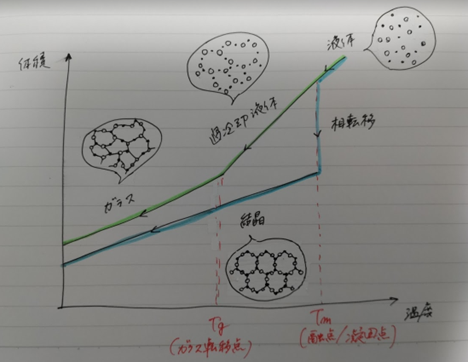
温度の低下にともない分子間の相互作用の影響が強くなるにしたがって、自由体積は小さくなっていきます。
結晶化する場合、液体から固体に変わる凝固点を境に、この自由体積の減少率は急激に小さくなります。
後で触れますが、結晶状態というのは熱的に最もエネルギーが低く安定した状態です。
そのため徐々に冷却していき凝固点を過ぎると、分子は規則的に配列して結晶化する方向に向かいます。
そうすると分子同士はきちんとした配列で並ぶので、自由に動ける体積が少なくなります。そのため自由体積が急激に減少します。
「徐々に冷却」というのがポイントで、「比較的早く冷却」した場合は別の挙動を示します。それがガラス転移という現象です。
早く冷やすと、分子が並ぶ前に分子の動きが止まってしまいます。これがガラスになる理由です。
きれいに整列する前に分子の動きが小さくなっていくため、凝固点を過ぎても分子は比較的大きな自由体積を持っており、ゆっくりと動き続けることができます。
そしてある温度になると自由体積の減少率が急に小さくなり、動きが止まってしまいます。
このときの温度をガラス転移点といい、アモルファス状態のまま固まったガラス状態になります。
ガラスの結晶化
安定状態と準安定状態
アモルファスの状態は熱的に準安定状態と言われます。
エネルギー状態が最も低い状態を安定状態と言いますが、準安定状態はそれに準じて局所的に安定した状態という意味です。
これは完全に安定した状態ではないものの、この状態を変化させるにはエネルギーの障壁があり、この障壁を超えるような一定以上の大きなエネルギーを外部から与えない限りは安定しています。
逆に言えば、大きなエネルギーを与えれば、この安定性は崩れてしまいます。
これまでに何度か出てきたエネルギー障壁の考え方です。
あるところから別の場所に行くのには山を越えないといけないということです。
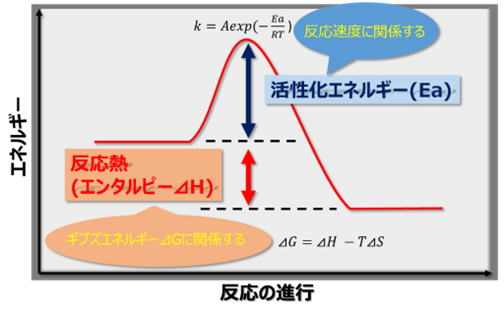
ガラスについて言うと、結晶構造は安定状態、アモルファス構造は準安定状態であり、一定以上の熱を加えると、アモルファス状態から結晶状態への変化が起こります。
ギブス自由エネルギー
このような変化を考えるのに有効な、ギブス自由エネルギーという考え方があります。
ギブス自由エネルギーは、エンタルピーとエントロピーという二つの力のバランスにより、次の式で示されます。
G = H – TS
G:ギブス自由エネルギー
H:エンタルピー
T:温度
S:エントロピー
ごく簡単に説明すると、
エンタルピーとは、ものがくっつきたがる力、
エントロピーとは、ものがバラバラになりたがる力、
ギブス自由エネルギーは物質の変化したがる力、
ということができます。
そしてこれらは温度によって決まります。
どういうことかというと、
例えば、部屋に2人の人がいるとします。
部屋がすごく寒いとすると、2人は身をよせあって固まります。これはエンタルピーが働いていると考えます。
部屋を暖かくしていくと、2人は離れて別々に動くようになります。これはエントロピーが働いていると考えます。
もう少し実際の現象に則して言うと、
低い温度では水分子同士がくっつく力が強く働いて水は氷になります。
高い温度では水分子同士がバラバラになりたがる力が働いて氷は水になります。
ギブス自由エネルギーは、物質が変化したがる強さを表します。
温度によって、上記のくっつきたがる力とバラバラになりたがる力のバランスが変わるため、物質の変化したがる強さもそれに応じて変化します。
系はギブス自由エネルギーが最小になる方向に向かう、という原則があります。
アモルファス状態のガラスは準安定状態にありますが、一時的にギブス自由エネルギーが最小になっている(変化したがらない)と言えます。
ガラスに十分な熱を加えると、この準安定状態が崩れ、分子が動き出して並び方が変わります。これで、より安定した結晶の状態になります。
このようにしてアモルファス構造の中に結晶を成長させたのが結晶化ガラスと呼ばれる種類のガラスで、この中でも特に結晶化によりゼロ熱膨張特性を備えたものが前々回の記事にしたゼロ膨張ガラスということになります。
参考)
・希土類材料研究センタースライド資料「セラミックス材料学2019 ガラスの結晶化と構造」https://u.muroran-it.ac.jp/hydrogen/lec/Ceram06PPT.pdf
7/9(火)学習時間:6H
・岡野の化学(157)
・自由体積、ギブス自由エネルギーとガラス化、結晶化について
課題)
・自由体積が特許明細書の中でどのように使われるか確認する







コメントを残す