エステル化の反応機構のところで参照した資料に「脱離基は弱い塩基ほど脱離能がよいのでH2Oは優れた脱離基である」という説明があったのですが、「脱離のしやすさ」について理解できていなかったので調べたところをまとめます。
脱離基の脱離能(脱離のしやすさ)の前提として、共役酸と共役塩基の関係があります。
酸AHに対し、そこからH+がとれた塩基A-を「酸AHの共役塩基」といいます。

上の図でHAが強酸であるほど平衡は右に傾いてHAの電離が進みます。
また共役塩基のイオンA-が安定であるほど電離は進みます。
共役塩基が弱塩基であるほど平衡が右に傾くので「共役塩基が弱い塩基であるほど脱離しやすい」ということになります。
脱離のしやすさと強酸・弱塩基の関係は以下のようになります。
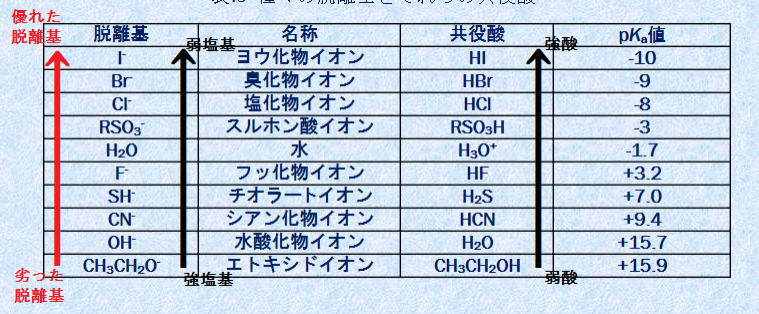
酸性の強さには共役塩基のイオンの安定化が関係するということで、次のような要素が関係します。
①原子半径の大きさ
:共役塩基イオンの原子半径が大きいほど電子が非局在化して安定する
例)酸性の強さ HI>HBr>HCl>HF
②電気陰性度の大きさ
:電気陰性度が大きいほど共有電子対を自身に引き付ける力が大きくなりH+を放出する
また電気陰性度が大きいほど電子親和力が大きくなる傾向があるので負電荷を持っても安定する
これは①のハロゲン化水素の酸性の強さと矛盾しそうですが、原子半径の大きさの方が優先するということです
③共役の有無
:共役塩基のイオンに共役があり共鳴構造が書けるほど電子が非局在化しており安定する
④軌道のS性の大きさ
:軌道のs性があがるほど電子を引き付ける力が強くなり安定化する
例)酸性の強さ アセチレン(sp混成軌道)>エチレン(sp2混成軌道)>エタン(sp3混成軌道)
⑤誘起効果
:共鳴構造をもち、さらに電気陰性度が大きい原子が含まれていると、電子を引き付ける力が両方で生じ、共役塩基のイオンがより安定化する
例)酸性の強さ トリフルオロ酢酸 >酢酸
⑥芳香族性
:共役塩基のイオンが芳香族性をもつと安定化する
芳香族性を持つかどうかについてはヒュッケル則が関係するようです→これは追加で調べます
参考)
https://sekatsu-kagaku.sub.jp/acid-base.htm
https://netdekagaku.com/huckelrule/#google_vignette
http://www.scc.kyushu-u.ac.jp/Yuhan/Top_Page/uchida_lab/_src/510/%E6%9C%89%E6%A9%9F%E7%89%A9%E8%B3%AA%E5%8C%96%E5%AD%A6%EF%BC%88%E9%85%B8%E3%81%A8%E6%A7%8B%E9%80%A0%EF%BC%89.pdf
「ボルハルトショアー 現代有機化学(上)」
「ブルース有機化学概説」(本は持っていないのでGoogle Booksでハロゲン化物イオンの安定性についての部分だけ読みました)
4/21(日)学習時間:12.25H
・岡野の化学(26)~(30)
・脱離能、酸性度について
・ハロニウムイオン中間体の安定性について
→フルオロニウムイオンの存在が実験的に確かめられたという論文が2013年に出ていることを発見。逆にそれまでは環状フルオロニウムイオンは見つかっていなかったということで、やはりハロゲンの軌道の大きさがハロニウムイオンの安定化と関係するのだろうか。少し深入りしすぎている気もするのでまた無機化学でハロゲンの性質が出てきたときに考えることにしたい。
課題)
・これまでの学習ででてきた脱離反応を脱離能に着目して復習する
・同じOH基をもつ化合物でもフェノールとカルボン酸は酸性で水とアルコールは中性になる理由を電離のしやすさ、共役塩基のイオンの安定性から考える
・ラジカル反応について調べるといってなかなか進んでいなかったが、酸の電離について調べている過程で、酸の電離のようにイオンに分かれるヘテロリシス開裂、共有電子対の間で均等に分かれて不対電子をもつラジカルができるホモリシス開裂があるという話が出てきたので、ここからラジカル反応の話に入る予定
・ヒュッケル則について調べる









コメントを残す