岡野の化学で気体の溶解度について学習しました。
以前の単元で学習した固体の溶解度についての復習も兼ねてまとめます。
ものが溶けるということ
塩を水に入れて食塩水をつくるとき、塩の白いかたまりはなくなって透明の液体になります。
しかし、塩は消えてなくなってしまうわけではありません。
化学において物質が「溶ける」という現象、すなわち「溶解」では、どんなことが起きているのでしょうか?
溶解という現象を考えるうえで大事な3つの言葉があります。それは「溶質」「溶媒」「溶液」です。
溶質:溶ける物質(固体・液体・気体)
溶媒:溶質を溶かす液体
溶液:溶質と溶媒が混ざりあってできた液体。溶媒が水の場合のを特に「水溶液」という
溶解が起きるとき、溶質の分子やイオンは1つずつバラバラになり、溶媒分子に取り囲まれて均一に散らばります。
溶質分子が溶媒分子に取り囲まれた状態を「溶媒和」と言います。特に溶媒が水の場合に「水和」と言います。
そして溶解によってできた溶液は、時間の経過によって元の溶質と溶媒に分かれるということはありません。
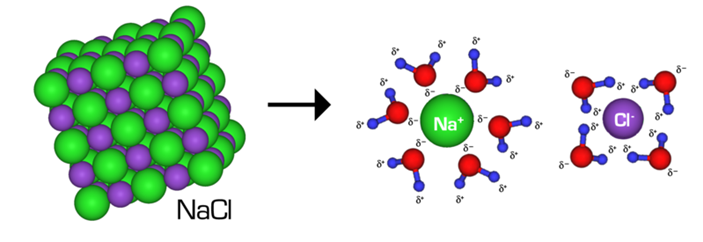
NaClが水に溶ける場合を考えてみましょう。
溶媒である水分子は、H原子とO原子の電気陰性度の差、つまり電子を自分の方に引っ張ってくる力の強さの違いにより、δ+(わずかにプラス)とδ–(わずかにマイナス)に分極しています。
NaClはNa+とCl–のイオンが結合してできた結合結晶のため、極性を持ちます。
そのため、Na+イオンをH2O分子のδ+の部分が、Cl–イオンをH2O分子のδ–の部分が、それぞれ取り囲み、水和イオンを形成して水中に分散させます。
普段の生活で料理を作るときなどは、小麦粉を水に「溶かす」という言い方をします。しかし、これは「溶解」という現象には含まれません。
なぜかというと、小麦粉が水に溶けた状態というのは、デンプン分子のかたまりが水の中に散らばっているだけで、デンプン分子が1つ1つバラバラになって溶媒分子に囲まれているわけではないからです。
そして一度混ざり合ったように見えても時間が経つと小麦粉と水に分離してしまいます。
このような場合は溶解にあてはまりません。
溶質には固体・液体・気体のいずれもあります。それぞれ例えば次のようなものがあります。
溶質が固体の例:
溶質:NaCl
溶媒:水
溶液:塩化ナトリウム水溶液(食塩水)
溶質が液体の例:
溶質:エタノール
溶媒:水
溶液:清酒
溶質が気体の例:
溶質:二酸化炭素
溶媒:水
溶液:炭酸水
物質の溶けやすさを表す指標に「溶解度」というものがあります。
溶質は溶媒にある量までは溶けることができますが、量が多くなると溶けきれなくなります。溶質が溶媒に最大限溶けている状態の溶液を飽和溶液と言います。
溶解度はこの飽和溶液での濃度を指し、一般的には溶媒100g中に溶けている溶質の質量(g)で表されます。
溶解度は温度によっても違いがあります。
この点を、溶質が固体の場合と気体の場合でそれぞれ見てみましょう。
固体の溶解度と温度の関係
冒頭に書いた通り、溶解は次の二段階を経ます。
①溶質が1分子ずつバラバラになる
②バラバラになった溶質分子が溶媒分子が溶媒和をつくる
①の段階では、溶質分子同士の結合・分子間力を切断するためのエネルギー、
②の段階では、溶質分子と溶媒分子との間に結合・分子間力を形成するためのエネルギー、
がそれぞれ必要になります。
分子はバラバラでいるよりも結合している方が安定するため、
結合を切断する反応は吸熱反応(外部からエネルギーを奪う反応)、
結合を形成する反応は発熱反応(エネルギーを外部に放出する反応)、
となります。
これらのエネルギーの総和で、その物質の溶解反応が発熱反応となるか吸熱反応となるかが決まります。
多くの溶質の場合、溶解は吸熱反応となります。
さて、今まで何度か平衡という考え方が出てきましたが、溶解に関してもその考え方が関係します。
平衡状態とは、可逆的な反応について、正反応と逆反応の反応速度がつり合い、見かけ上反応が止まっているように見える状態です。
例えば、液体の水を加熱すると蒸発して水蒸気になります。しかし、ある程度まで蒸発すると今度は水蒸気が液体に凝縮する反応も起こります。この2つの反応が同じ速度で起きると、反応が止まってつり合ってみえる状態になります。
平衡状態にある時に例えば濃度、温度、圧力などの条件を変化させた場合、その変化を打ち消す方向に平衡が傾くという法則(ルシャトリエの原理)があります。
溶解に関していうと溶質が溶媒に溶けて溶液になっている状態は平衡状態が保たれているわけですが、ここで外部から熱を加えて温度を上げた場合、ルシャトリエの原理によって温度を下げる方向に平衡が傾きます。
つまり、溶解が吸熱反応であれば、温度を下げるために溶解反応が進むということになります。
よって、一般的には温度を上げると固体の溶解度は高くなるのです。
再結晶
温度が高くなるほど固体の溶解度が高くなる、という性質を利用した分離方法に「再結晶」という方法があります。
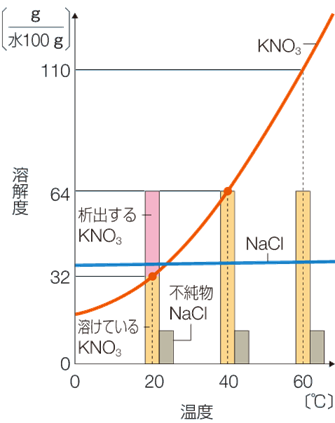
例えば図のようにKNO3とNaClの両方が水に溶けた水溶液があるとします。
この場合、KNO3の溶解度は40℃のときは64g、20℃では32gですので、40℃から20℃まで溶液の温度を下げると溶けきれなくなったKNO3が32g取り出せます。
グラフを見ると不純物として混ざっているNaClの量は20℃の時の溶解度よりも少ないため、20℃まで温度を下げてもNaClは析出してきません。
そのためKNO3の純粋な結晶だけが取り出せます。
このように物質の溶解度の差と温度変化を利用して純粋な結晶を取り出すのが再結晶という方法です。
固体の溶解度と温度の関係の例外
再結晶法は温度を上げると溶解度が大きくなるという前提に立っていましたが、実はどんな固体でもそうなるわけではありません。
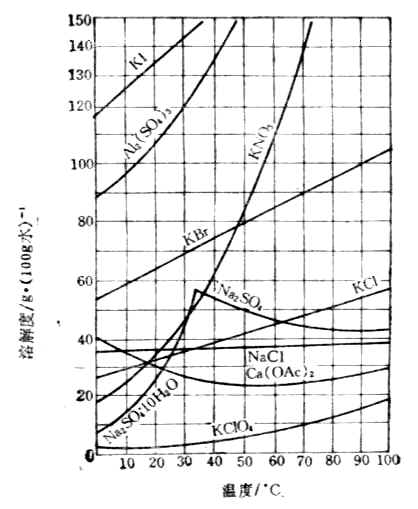
下図は様々な物質の溶解度を表した溶解度曲線です。
おおむね右肩上がりのグラフになっていますが、例外もあることが分かります。
溶解熱が吸熱になるか発熱になるかという話を上で書きましたが、このような例外的な反応も熱エネルギーの関係から考えられます。
塩化ナトリウム(NaCl)
温度上昇とともにわずかに溶解度が上がりますが、ほぼ横ばいです。
まずNaClの溶解熱は-3.9kJと小さいです。
これはNaClのNaとClの結合を切断する際に吸収するエネルギーを上回るほどではないけれども、Na+イオンとCl–イオンが水和する際に放出するエネルギーが大きいためです。
NaClの結合には及びませんが、極性のあるH2O分子と、Na+イオンとCl–イオンがそれぞれ水和イオンを形成する状態はとても安定しているため、水和イオンを形成する際に放出するエネルギーが大きいのだと考えられます。
先にルシャトリエの原理について書きましたが、NaClの溶解熱は小さいため、温度上昇に対して平衡状態を保つために温度を下げようとする働きは小さくなります。
よって、温度上昇にともなって溶解度は右肩上がりにはなりますが、その変化は他の物質に比べて非常に小さいということになります。
水酸化カルシウム(Ca(OH)2)
温度上昇とともに溶解度が小さくなっていきます。
これはCa(OH)2の溶解熱が発熱反応であるためです。
周囲の温度が高くなっているときに溶解反応が生じると、発熱反応によって余計に温度が上昇してしまいます。
平衡状態からの変化を小さくする方向に反応が進むという原則で考えると、温度変化を抑えるために溶解反応が抑えられるということになります。
よって水酸化カルシウムの場合は温度を上げるほど溶解度が小さくなります。
硫酸ナトリウム(Na2SO4)
32.4℃までは温度上昇にともなって溶解度も大きくなりますが、32.4℃を超えると逆に温度上昇とともに溶解度が小さくなっていきます。
これは硫酸ナトリウムの結晶構造が異なるためです。
32.4℃以下では結晶の中に水分子が含まれたNa2SO4・10H2Oという水和物の形で存在しています。このときの溶解熱は吸熱となります。
一方で32.4℃以上になると結晶中の水分子が取れてNa2SO4になります。このときの溶解熱は発熱となります。
そのためルシャトリエの原理にしたがって、32.4℃までは右肩上がり、32.4℃を過ぎると右肩下がり、という溶解度グラフになるのです。
気体の溶解度と温度の関係
気体の場合は固体の場合とは逆で、一般的に温度が上がると溶解度が小さくなります。
なぜかというと、溶液の温度が高くなると溶質の気体分子に熱エネルギーが与えられて、気体分子の運動が活発になるためです。
運動が活発になった気体分子は溶液から飛び出てしまうため、温度上昇にともなって溶解度が下がります。
気体の溶解度曲線についても見てみましょう。
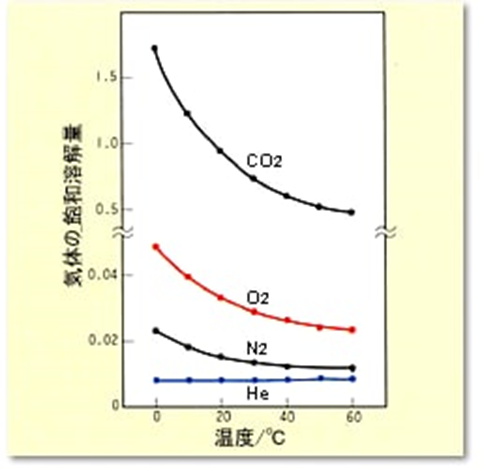
CO2は低温での水への溶解度が大きく、温度を上げた場合の溶解度の変化も大きくなっています。
一方Heは温度による変化がほとんどなく、低温でも高温でも水への溶解度は非常に小さいです。
これは水分子との相互作用の起こりやすさによる違いと考えられます。
CO2の場合はC原子とO原子の電気陰性度の違いにより分極しています。
さらに水分子のHとCO2のO原子の間で水素結合が働くと考えられます。
そのため、低温で気体分子の運動が活発でないときには水分子との相互作用が強く働いて水に溶けやすくなります。
対するHeは希ガスに分類されます。希ガスの特徴は、結合に大きく関与する最外殻が電子で満たされているため、単独で安定しており、反応性に乏しいことです。
つまりHeの場合は温度によらず水分子との相互作用がほとんど生じないため、水への溶解度が非常に低く、温度による溶解度の変化もほとんど見られないのです。
気体の溶解度と圧力の関係
気体の場合は温度だけではなく、圧力も溶解度に関係します。
それを表したのがヘンリーの法則です。
温度が一定であれば、一定量の溶媒に溶ける気体の物質量はその気体の圧力(分圧)に比例する
温度が一定であれば、一定量の溶媒に溶ける気体の体積は、その圧力下で測定すれば、圧力に関係なく一定である
というものです。
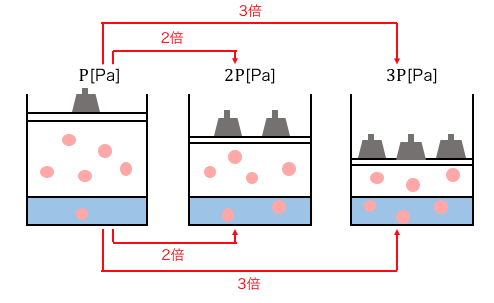
前提になっているのはボイルの法則で、理想気体について、温度が一定なら圧力と体積は反比例するというものです。
つまり、圧力が2倍になれば溶解する気体の体積は1モルあたり1/2になります。
ただしヘンリーの法則により2倍の圧力をかければ2倍のモル数が溶けるので、溶けている気体全体の体積は1/2×2=1で、元の圧力の場合の体積と同じになります。
ただし、HClやNH3のようにイオンになって水分子に大量に溶け込んでしまうような気体の場合にはヘンリーの法則は成立しません。
炭酸飲料は容器をふたで密閉されて圧力の高い状態になっています。そのため気体の二酸化炭素は水の中に多く溶け込んでいます。
ところがふたを開けると容器の圧力が低くなって溶解度が下がり、溶けきれなくなった二酸化炭素が勢いよく出てきます。
また温度を上げることでも二酸化炭素の溶解度は下がるので、夏場の熱気で温められたときはより激しく中身が飛び出てくるのです。
参考)
・日本化学会近畿支部 ”小・中・高生の化学のページ” http://kinki.chemistry.or.jp/pre/a-374.html(参照2024-07-16)
・理科年表編集委員会 ”気体の水に対する溶解度” 理科年表オフィシャルサイト https://official.rikanenpyo.jp/posts/6173(参照2024-07-15)
7/15(月)学習時間:9H
・岡野の化学(161)
・溶解度と温度の関係の例外について
課題)
・水和物が存在する結晶と存在しない結晶の違いについて
その他
・3041 考え方のトレーニング




コメントを残す