岡野の化学でコロイドの凝析・塩析について学習したのでそのまとめと、電気二重層について追加で調べたこと、参照した特許について書いてみます。
コロイドとは
まずコロイドとは何かを確認します。
コロイドとは、直径が1nm~1㎛程度の大きさの粒子が、他の物質の相の中に分散した系のことです。
1㎛は1mmの1000分の1、1nmは1㎛のさらに1000分の1の長さです。
原子の直径は約1Å(オングストローム)、つまり0.1 nmですので、コロイド粒子は原子やイオンに比べれば比較的大きな粒子だと言えます。
ろ紙は通れるけれども、半透膜は通れない、という大きさです。
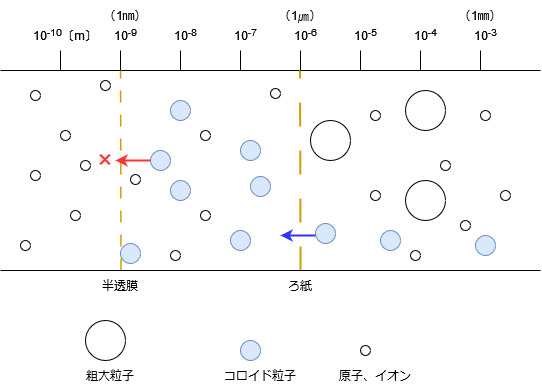
分散した系というと何のことだかピンとこないかもしれませんが、日常の色々なところにコロイドがあります。
分散するコロイド粒子を「分散質」といい、分散される相を「分散媒」といいます。
分散質は固体または液体、分散媒は固体・液体・気体のいずれかの状態で、それぞれの組み合わせで以下のような例があります。
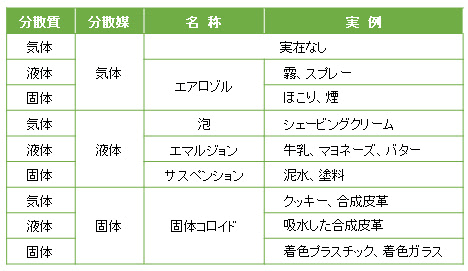
コロイドのことをコロイド溶液という言い方もしますが、NaClaqなどの溶液(コロイド溶液と区別するために「真の溶液」とも呼ばれる)とは異なります。
真の溶液では、溶質(溶ける物質)がさらに小さな分子や原子やイオンにバラバラに分かれて、溶媒(溶かす物質)分子に囲まれて溶媒内に均一に広がることで溶解します。こうしてできた溶液は透明になります。
コロイド溶液の場合は、溶解ではなく分散という現象が起きています。分散の場合は、分散質がさらに小さな分子や原子やイオンに分かれることはなく、分散媒の中に均一に散らばっています。コロイド溶液は比較的大きな粒子が分散しているために光がぶつかって散乱し、半透明に見えます。
凝析と塩析
コロイドには凝析と塩析という現象がみられます。
どちらも、水を分散媒とするコロイド粒子に電解質(溶解したときにイオンに分かれる物質)を加えるとコロイド粒子が沈殿する現象、という点は共通しています。
凝析と塩析の大きな違いは、沈殿するコロイド粒子の種類です。
コロイド粒子の種類は水との親和性に着目すると疎水コロイドと親水コロイドに分けられます。
名前の通りですが、疎水コロイドは水との相性が悪いコロイド粒子、親水コロイドは水との親和性が高いコロイド粒子です。
疎水コロイドに少量の電解質を加えると沈殿が生じる現象(あるいはそれを起こさせる操作)を凝析、
親水コロイドに多量の電解質を加えると沈殿が生じる現象(あるいはそれを起こさせる操作)を塩析、と呼んでいます。
疎水コロイドの凝析
疎水コロイドの凝析がどのようにして起こるのかを見ていきましょう。
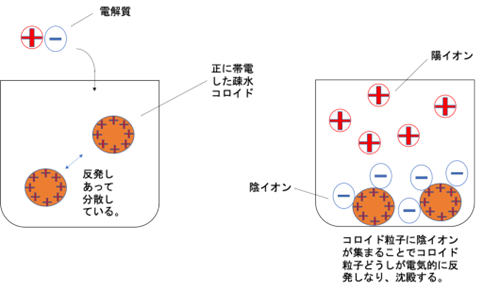
まず、電解質を加えない状態では、疎水コロイド同士はお互いの電荷で反発し合って浮かんでいます。
電荷と言いましたがコロイド粒子の表面は単純にプラスかマイナスのどちらかだけに帯電しているというわけではなく、電気二重層という電荷の層ができています。
これは粒子表面の電荷を打ち消すように、反対の電荷をもったイオン(対イオン)が表面近傍に分布することによってできるものです。
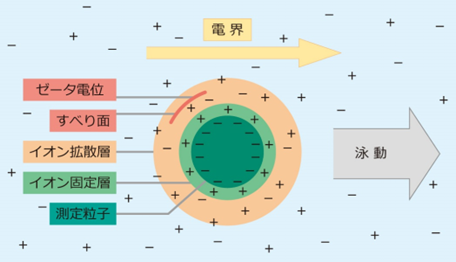
物質表面の電荷がどのような状態であるかを突き止めることは難しく、電気二重層には歴史的にいくつかのモデルが考えられてきました。
代表的な次の3つのモデルについて簡単に見ていきます。
①ヘルムホルツモデル
②グイ-チャップマンモデル
③シュテルンモデル
①ヘルムホルツモデル
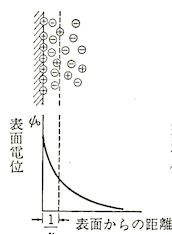
電気二重層の最も簡単なモデルです。
表面電荷と同量の溶液相中の対イオンが、表面から一定の距離を隔てて並んでいるというモデルです。
②グイ-チャップマンモデル
二重層の拡散という概念を取り込んだモデルです。
ヘルムホルツモデルではイオンが特定の箇所に集まっていましたがこれは不自然で、過剰なイオンの一部は溶液相の内部へ拡散して平衡状態を保とうとするのではないか、と考えたのです。
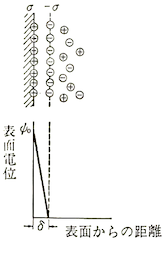
電荷の分布は表面からの距離をとるにつれて指数関数的に減少するとしました。
ヘルムホルツモデルの電位と距離の関係を表した直線的なグラフの傾きと比較して、グイ-チャップマンモデルではグラフが曲線を描いていることがわかります。
③シュテルンモデル
グイ-チャップマンモデルによって理論は大きく進歩しましたが、同モデルではイオンを点電荷として捉えていました。
点電荷とは、「大きさを無視できる、電荷をもった物体」のことです。
議論を簡単にするために理想的な状態を前提にする、という考え方は理想気体について学習したときなどにも出てきました。
シュテルンモデルではこれをもう少し現実に即した形にしようとして、イオンの大きさを考慮することを考えたのです。
実際にはそれぞれのイオンには大きさがあるので、近づいていくとどこかでお互いにぶつかってそれ以上は近づけなくなります。
つまり、イオンはある一定の距離までしか表面に近づけない、ということになります。
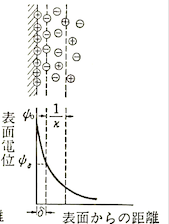
そこでシュテルンモデルではヘルムホルツモデルとグイ-チャップマンモデルの両方を取り入れて、物質表面にイオンが最も近づいたときの一定の距離をヘルムホルツ面として、その内側(物質表面側)をヘルムホルツ層、外側(溶液相側)をグイ-チャップマン層としました。
下図だと圧縮されてしまって少しわかりづらいですが、表面から距離δで表されている部分までは一定の直線的な傾きのグラフになっていて、この部分はヘルムホルツモデルを取り入れています。
そこから先は曲線を描いていて、グイ-チャップマンモデルを取り入れていることがわかると思います。
このようにコロイド粒子の表面には電気二重層が出来ていて、単純に粒子表面の電荷の影響を受けるわけではなく、電気二重層の全体的な電荷の影響を受けるということです。
疎水コロイド同士はこの電気二重層に同じ電荷を持つため、互いに反発しあって沈まずにいられます。
ところがここに電解質を入れると、対イオンが電気二重層の電荷を変化させて、疎水コロイドの電気二重層の厚みが減少します。
すると疎水コロイド同士が反発する力が弱まって、お互いの分子間力でくっつき合います(凝集)。
するとコロイドは大きなダマのようになって浮かんでいられなくなり、沈殿します。
これが凝析という現象です。
親水コロイドの塩析
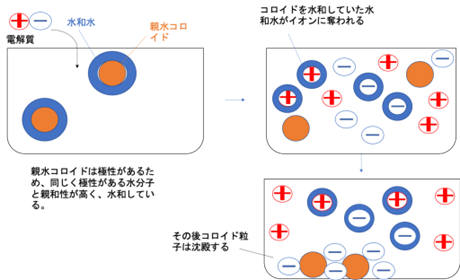
親水コロイドの場合は水との親和性が高いので、周囲を水分子が囲んで水和層と呼ばれる膜ができたような状態になっています。
親水コロイドの場合も電気二重層の影響はありますが、主にはこの水和層のおかげで、親水コロイド同士がくっつき合うことなく分散しています。
ここに多量の電解質を加えると、水和層が電解質のイオンによって引きはがされます。
疎水コロイドの場合は少量の電解質でよかったのになぜ親水コロイドの場合は多量の電解質を加えるのかというと、水が分散媒となっていれば周囲にいくらでも水分子が存在するので、取り除いても取り除いても、次々と別の水分子が親水コロイドにくっついてきてしまうからです。
多量の電解質を加えることでようやく水和層が薄くなり、親水コロイド同士がお互いの分子間力によって凝集します。
すると疎水コロイドの凝析のときと同様に、大きなダマになって沈殿します。
これが塩析という現象です。
凝析を利用した特許技術
凝析や塩析によるコロイドの沈殿を応用した例として、講座ビデオでは水の浄化が紹介されていました。
液体の中のコロイドが沈殿すれば不純物の少ない上澄み液ができるので、それを利用して水の浄化が行われるということです。
では逆に沈殿物の方を利用する方法はないかと考えてみて、何か特定の分散質を取り出したいときにそれを沈殿させることで効率よく回収するという方法があるのではないか、と想像しました。そこで「凝析」と「回収」をキーワードに特許庁DBを検索してみたところ、いくつかヒットしました。
その中で、凝析現象を利用してラテックスの粉体を効率よく回収するという技術がありました。
ラテックスはゴムの元になるコロイド分散液のことで、乳化重合という方法で作られます。
乳化重合は一般的に疎水性のモノマー(スチレンなど)を界面活性剤によって乳化しながら水中で重合するという方法を採ります。よって水中にポリマー粒子が分散したコロイドが得られます。
一般的には分散媒と分散質がどちらも液体の場合を乳化といいますが、乳化重合の場合は少し特殊です。液体のモノマーを分散質としてスタートしますが、最終的に生成するポリマー粒子(分散質)は固体になります。
ラテックスは一般的には疎水性のコロイドですが、乳化重合では界面活性剤に囲まれています。
この特許では乳化剤(界面活性剤)にベンゼンスルホン酸ナトリウムが適していると書かれています。
ベンゼンスルホン酸ナトリウムの疎水基部分はラテックスのコロイドの方を向いて取り囲み、親水基が外側を向く格好になります。
親水基部分は、水中ではNaイオンが電離して-SO3–となります。つまり負の電荷を帯びることになります。
そこに酢酸カルシウムなどの電解質を加えると、正電荷のCaイオンが-SO3–の方に引き付けられます。
Naイオンは1価のイオンですが、Caイオンは2価のイオンであるため、電荷の影響が大きくなります。
するとポリマー粒子を取り巻く電荷のバランスが変化してポリマー粒子同士の反発が弱まり、ポリマー粒子同士の相互作用による凝集が進行して、沈殿すると考えられます。
このようにして沈殿させたポリマー粒子はろ過による固液分離で回収されます。
最初に書いたようにコロイド粒子は本来ろ紙を通り抜けてしまう大きさですが、凝析によっていくつかのポリマー粒子が凝集して大きな塊になったことでろ紙を通り抜けられなくなり、ろ過によって回収することが可能になったのだと考えられます。
物質表面付近の電荷が様々な条件の中でどのように変化するのか、まだ十分に理解できていません。
今後色々な特許明細書を読んでいく中で具体的な事例を確認しながら理解していきたいと思います。
7/21(日)学習時間:10.75H
・岡野の化学(169)~(171)
課題)コロイドに関する資料をいくつか印刷したので読む
その他
・3321 「岡野の化学」の使い方





コメントを残す