岡野の化学でハロゲンについて学習したので、今まで学習したことの確認を織り交ぜながら、ハロゲンの性質についてまとめました。
ハロゲンとは
ハロゲンとは周期表17族の元素のことです。
代表的なものは、原子番号の小さい方から順に次の4つです。
F:フッ素
Cl:塩素
Br:臭素
I:ヨウ素
ハロゲンは通常2原子分子で存在し、常温での状態と色はそれぞれ次のようになっています。
フッ素:常温で淡黄色の気体

塩素:常温で黄緑色の気体

臭素:常温で赤褐色の液体

ヨウ素:常温で黒紫色の固体

写真を載せましたが、フッ素の写真はフッ素ガスを冷却して液体にしたもので、気体状態の写真は見つかりませんでした。
それもそのはず、フッ素ガスは非常に反応性が高いため、単体のガスの状態で存在するのは非常に稀なのです。
ハロゲンはいずれも反応性が高いですが、フッ素はその中でも特別です。
なぜフッ素がこのように高い反応性を示すかは、フッ素の酸化力、陰イオンになる傾向の強さから説明ができます。
この点を次で見ていきましょう。
ハロゲン単体の酸化力
ハロゲンの酸化力の強さは次のようになっています。
F2 >Cl2 >Br2 > I2
なぜこのようになるのかを考えてみましょう。
まず、酸化力とは何かを確認します。
酸化力とは、相手を酸化する力のことです。
相手を酸化するということは、自身は還元されるということです。
酸化還元の定義は4つあります。
①酸素のやりとりに注目した定義
酸化: 酸素を得ること
還元: 酸素を失うこと
②水素のやりとりに注目した定義
酸化: 水素を失うこと
還元: 水素を得ること
③電子のやりとりに注目した定義
酸化: 電子を失うこと
還元: 電子を受け取ること
④酸化数に注目した定義
酸化: 酸化数が増えること
還元: 酸化数が減ること
今回はこの中でも③の定義に注目します。
酸化力が強いということは、自身は還元されやすいということ、つまり電子を受け取る傾向が強いということになります。
冒頭に書いたようにハロゲンというのは17族の元素です。
ハロゲンのとなりの18族は希ガスといい、最外殻が電子で満たされた閉殻状態になっていて最も安定した状態です。
ハロゲンは最外殻にあと一つ電子が入って1価の陰イオンになれば、希ガスと同じ電子配置になれるという状態です。
そのためハロゲンは電子を受け取って陰イオンになろうとする傾向が強いのです。
ここまでを整理すると、
酸化力が強いということは、陰イオンになる傾向が強いということ
となります。
そこで、ハロゲンの酸化力の強さを比較するには陰イオンになる傾向の強さを比較すればよい、ということになります。
ではどのハロゲンが特に陰イオンになりやすいのでしょうか?
それは原子の軌道を見るとわかります。
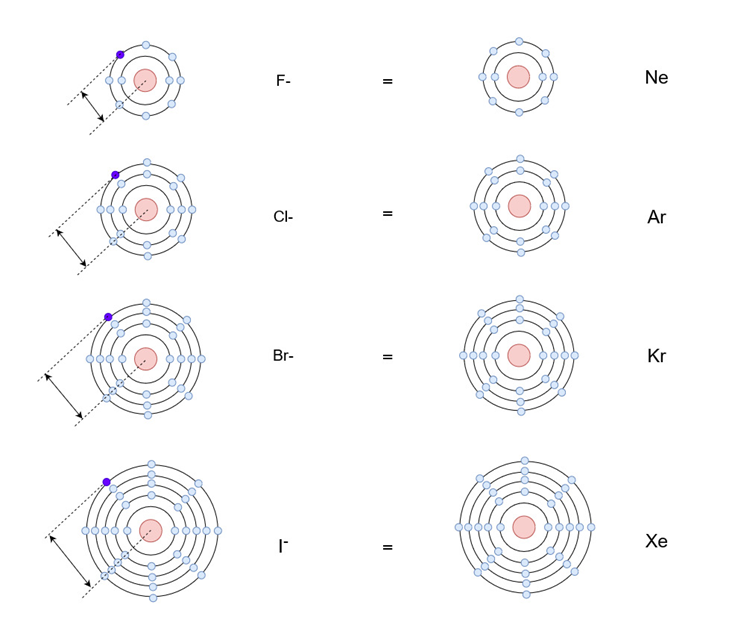
上図の左側にハロゲンイオンが書いてあります。
元のハロゲン原子の最外殻に1つ電子が入って最外殻が満たされ、希ガスと同じ安定状態になっています。
イオンになるにあたって受け取った電子を紫色で示していますが、原子番号が小さい方が原子核からの距離が近くなっていることが分かります。
原子核は正電荷を帯びており、電子が入る軌道が原子核から近い方が強く引き付けられるため、陰イオンになりやすいということが言えます。
電子が入る軌道が外側になるにつれて原子核からの距離は遠くなり、さらにその内側にある殻を満たしている電子が原子核の影響を受け止める効果(シールド効果)を発揮するので、陰イオンになる傾向は弱まります。
したがって、陰イオンになりやすい方から順に、
F2 >Cl2 >Br2 > I2
という順番になります。
そしてこれは酸化力の強さと同じになります。
よって、ハロゲンの酸化力の強さは
F2 >Cl2 >Br2 > I2
という順番になるのです。
ハロゲンの分子間力と沸点・融点
ハロゲンの沸点・融点の高さと分子間力の強さはいずれも以下の順になっています。
I2 > Br2 > Cl2 > F2
なぜこの順になるのかを考えてみましょう。
この順番は周期表をみると分かる通り、分子量が大きい方から小さい方へ並んでいます。
分子間の沸点・融点を考えるときは、分子間力の強さが問題になります。
ハロゲン分子の間には、ファンデルワールス力という弱い分子間力が働いています。
ファンデルワールス力には主に以下の3つの効果が関係しています。
・配向効果
・誘起効果
・分散効果
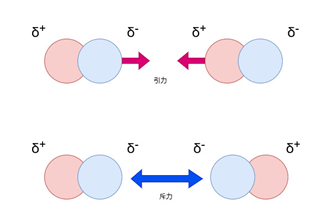
配向効果:
配向効果とは、電荷の偏りをもつ分子同士の間に生じる相互作用のことです。
分子同士に電荷の偏りが生じている場合、分子の向きによって引力あるいは斥力が働きます。
相対的にみるとその平均としての力が働いています。
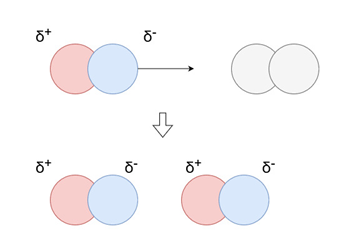
誘起効果:
電荷の偏りを持つ極性分子が無極性分子に近づいたとき、無極性分子が極性分子の電荷の影響を受けて自身も電荷の偏りを生じることによって生まれる相互作用です。
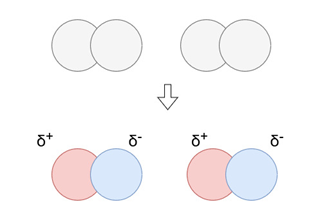
分散効果:
無極性分子同士の間でも、電子の配置の一時的な偏りにより、瞬間的に電荷の偏りが生じることがあります。
この際の相互作用を分散効果といいます。
ハロゲン分子は電荷の偏りが生じていない無極性分子の状態ですので、分子間に働くファンデルワールス力の中でも分散効果が最も大きく影響しています。
一時的な表面の電荷の偏りによる影響は、分子の大きさが大きく接触面積が増える方が強くなります。
つまり、分子量が大きくなるほどファンデルワールス力による分子間力が大きくなります。
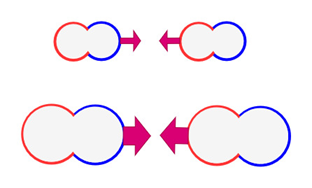
沸点や融点で分子が気体あるいは液体になるとき、周囲の分子と距離ができて自由に運動できるスペースが多くなる必要があります。
しかし分子間力が強いと周囲の分子との結びつきが強く、自由に運動することが難しくなります。
そのため、分子量が大きくなるにつれて分子間力が大きくなり、沸点も高くなるというわけです。
ちなみに、分子間力の強さは形状によっても影響を受けます。
分子量がほぼ等しい場合、直鎖状の分子の方が分子同士が接触する面積が増えるため分子間力が大きくなります。
分子の形状による分子間力が物質の性質に影響を与える例としては、二重結合を含む不飽和脂肪酸があります。
二重結合を介して結合している炭素は回転ができないため、2つの炭素に共通の基が結合している場合にそれが上下の同じ側にあるか反対側にあるかによって、シス型とトランス型が存在します。
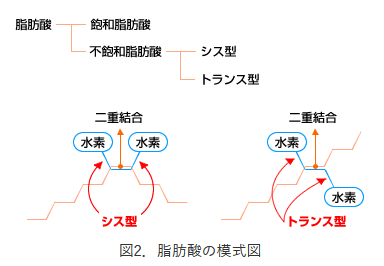
シス型は全体的に「く」の字に折れ曲がったような形になるのに対して、トランス型は直鎖に近い形になります。
そのためトランス型の方が分子同士が接触しやすく分子間に働くファンデルワールス力が大きくなります。
よって、シス型よりも融点が高くなり、溶けにくい脂肪になるのです。
トランス型の脂肪酸は牛・羊の肉や乳、それらの加工製品に多く含まれ、シス型の脂肪酸は植物油などに多く含まれます。
バターが常温で固体なのに対してサラダ油が液体なのはこのような分子の形状と分子間力の影響が関係しているのです。
ハロゲン化物
ハロゲン単体の性質について見てきましたので、次はハロゲンの化合物について見ていきましょう。
ハロゲン化銀の水溶性
ハロゲンイオンは1価の陰イオンになるため、1価の陽イオンであるAg+とイオン結合してハロゲン化銀を生じます。
ハロゲン化銀のうち、AgCl、AgBr、AgIの3つはいずれも水に不溶で沈殿してしまいますが、AgFだけは水に溶けます。
なぜでしょうか。
これはハロゲンの電気陰性度の違いによって生じるハロゲン化銀の分極の差にポイントがあります。
電気陰性度とは、結合している原子が電子を引き付ける力の強さを表しています。
周期表で見ると、おおむね右上にいくほど電気陰性度が大きくなっています。
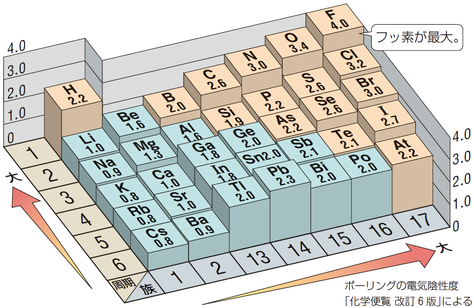
ハロゲンの中で見てみると、電気陰性度は大きい方から順に以下の順になっています。
F 4.0
Cl 3.2
Br 3.0
I 2.7
中でもFの電気陰性度は4.0と、すべての元素の中でも最大です。
結合している原子間の電気陰性度に差が生じるほど、電子は一方に引き寄せられて分極(電荷の偏り)が生じます。
Agの電気陰性度は上の図では省略されていますが1.9ですので、ハロゲンとの電気陰性度の差はそれぞれ次のようになります。
Agとの電気陰性度の差:
Ag-F 2.1
Ag-Cl 1.3
Ag-Br 1.1
Ag-I 0.8
イオン結合と共有結合に明確な境界はないものの、電気陰性度が1.7~2.0くらいのところが境目とされていることが多いようです。
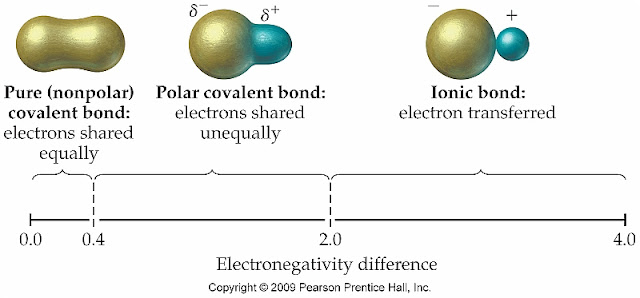
AgCl、AgBr、AgIはいずれも電気陰性度の差が2.0よりも小さく、イオン結合でありながらも分極の度合いが小さいことが分かります。
水分子は極性分子ですので、「似たもの同士が良く溶ける」という原則により極性分子をよく溶かしますが、非極性分子は溶かしにくくなります。
そのため、分極率の大きなAgFだけが水に溶け、分極率の小さい他のハロゲン化銀は水に溶けないのです。
ハロゲン化カルシウムの水溶性
ハロゲンは2価の陽イオンであるカルシウムイオンともイオン結合を生じます。
この結合によって生じる化合物をハロゲン化カルシウムといいます。
ハロゲン化カルシウムのうち、CaF2だけは水に溶けず、残りのCaCl2、CaBr2、CaI2はいずれも水に溶けます。
先ほどと同様に電気陰性度の差を確認してみましょう。
Caの電気陰性度は1.0ですので、それぞれ以下のようになります。
Ca-F 3.0
Ca-Cl 2.2
Ca-Br 2.0
Ca-I 1.7
先ほど見た1.7~2.0以上という基準に照らして、いずれも極性を持つことが確認できます。
そのためCaCl2、CaBr2、CaI2が水に溶けるのはうなずけますが、なぜ最も分極しているはずのCaF2だけが水に溶けないのでしょうか?
これは先ほどの説明と矛盾するように感じます。
水の場合のO-Hの電気陰性度の差である1.2と差がありすぎるためだという説明も見かけましたが、それなら先ほどのハロゲン化銀の説明で水の電気陰性度の差と近い値になるAgClやAgBrが溶けなかったのはなぜ?と疑問が残ってしまうので少し違うようです。
結論としては、CaF2の場合には電気陰性度以外の要素、格子エネルギー(lattice energy)が大きく影響しているためです。
格子エネルギーとは、結晶をその構成要素である原子、イオン、分子などに分けてばらばらにするのに必要なエネルギーのことです。
下の表を見るとCa-Fの格子エネルギーが最も高く、強固な結晶構造を作っていると考えられます。
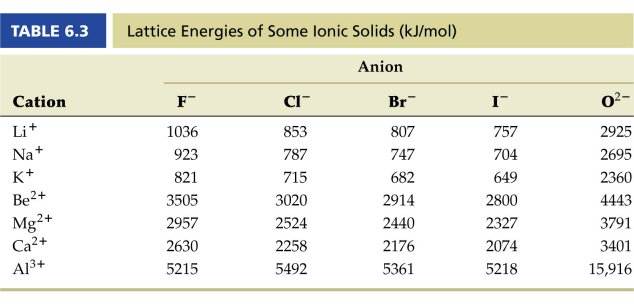
結晶が水に溶けるときには、結晶格子が壊れてから、バラバラになった原子やイオンが水分子と相互作用を起こして水和の状態になる、というプロセスを経ます。
バラバラになったイオンが水分子と水和するときに発生するエネルギーを水和エネルギー(hydration energy)と呼びます。
一般に、バラバラになったイオンは水和物を形成した方が安定化するため、水和エネルギーは発熱反応となります。
一方で格子エネルギーは結晶格子を壊すために外部からエネルギーを加えないといけないため吸熱反応となります。
溶解に関わるエネルギーは格子エネルギーと水和エネルギーの差で表され、水和エネルギーの値の方が大きいほど自然に溶解しやすくなります。
CaF2の場合は格子エネルギーが非常に大きいため、水和エネルギーを上回ってしまい、溶解しないのです。
ちなみにAgFの格子エネルギーは970.94kJ/molなのでCaF2の格子エネルギーはこれと比べてかなり大きいです。
Agイオンが1価の陽イオンであるのに対してCaイオンは2価の陽イオンなので、電荷の影響が大きく、より強固なイオン結合結晶を生じたのだと考えられます。
ハロゲン化水素の性質
続いて水素と結合したハロゲン化水素(Hydrogen Halide)の性質を見ていきましょう。
ハロゲン化水素の沸点
ハロゲン単体の沸点の高さは以下のようになっていました。
I2 > Br2 > Cl2 > F2
では、ハロゲン化水素の沸点の場合はどうなるでしょうか?
下のグラフを確認しましょう。
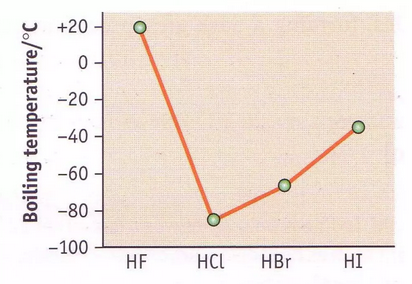
HCl、HBr、HIは分子量が大きくなるにつれて電荷の影響が大きくなるため、分子間にはたらくファンデルワールス力が強くなります。
これはハロゲン単体の分子間力の強さに関してみてきた通り、分子量が大きくなるほど分子間力が大きくなるため、沸点が高くなっています。
では、一番分子量の小さなHFが飛びぬけて沸点が高くなっているのはどういうことなのでしょうか?
先ほどの分子量と分子間力の説明では矛盾しているように思われます。
HFの沸点が例外的に高くなっているのは、ハロゲン化銀の説明で見たのと同じく、Fの電気陰性度の大きさと、それによって生じる水素結合に関係があります。
HFではFの電気陰性度が強いためにF側に電子が引っ張られて、F側がマイナスの電荷、H側がプラスの電荷に偏ります。
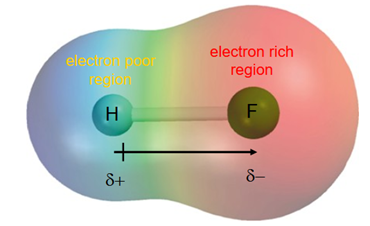
すると、分極によって生じたHの正電荷に引き付けられて周囲のHFのFが近づいていき、水素結合を生じます。
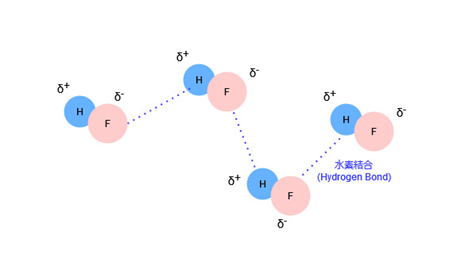
水素結合はファンデルワールス力の双極子-双極子相互作用に比べて、10倍程度強い分子間力を示すとされているため、水素結合の働くHFは他のハロゲン化水素に比べてずっと分子間力が強くなります。
したがって、分子量が小さいにも関わらず、沸点は最も高くなるのです。
ハロゲン化水素の酸性度
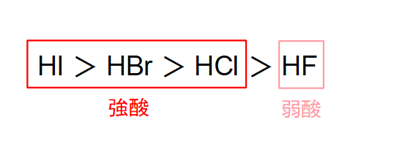
HF、HCl、HBr、HIはすべて無色の気体で、水に溶けて酸性を示します。
しかし、HCl、HBr、HIは強酸ですが、HFだけは弱酸です。
これはなぜでしょうか?
まず、酸性の強さがどのように決まるかを確認しましょう。
水溶液の酸性の強さは水素イオン濃度の高さによって決まります。
つまり、電離度(水中でイオンに分かれる度合い)が高いほど、酸性が強くなります。
電離度が高くなるためには、イオンになった状態が安定している必要があります。
ここで酸と塩基の適宜について確認しましょう。
酸・塩基の定義には代表的な定義が3つあります。
アレニウスの定義:
酸: 水に溶けるとH+ を出す物質
塩基: 水に溶けるとOH- を出す物質
ブレンステッドの定義:
酸: H+ を与える物質
塩基: H+ を受け取る物質
ルイスの定義:
酸: 電子対を受け取る物質
塩基: 電子対を与える物質
これらの定義は場面によって使い分けられますが、今回注目したいのはブレンステッドの定義です。
ブレンステッド酸がH+を供与した後に残る化学種のことを共役塩基(conjugate base)といいます。
ハロゲン化水素は以下の形で電離します。
HX ⇆ H+ + X–
ハロゲン化水素の共役塩基はHXからH+が取れた残りのX-、つまりハロゲンイオンということになります。
よって、ハロゲンイオンが水溶液中で安定しているほど酸性が強くなります。
そこでHFの場合を考えると、Fイオンのイオン半径は他のハロゲンイオンと比べて小さくなっています。
下図の周期表の黒い丸がイオン半径を表しています。
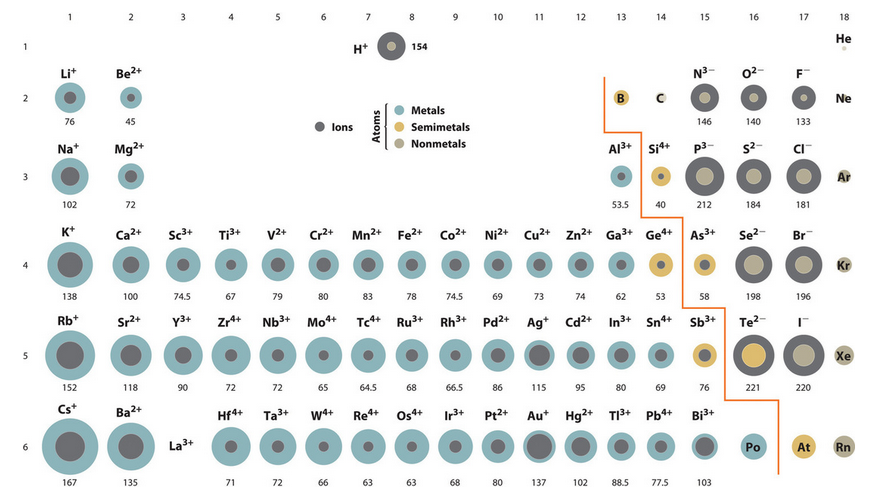
原子半径とで違いが生じているのは、電子の数の変化によって、使う軌道や電子が原子核に引き付けられる力に違いが生じるためです。
例えば、陽イオンになりやすい1族のアルカリ金属は原子半径よりもイオン半径の方が小さくなっています。
これはイオンになる際に最外殻の電子を1つ放出することにより、最外殻の軌道が一つ内側に入って小さくなるためです。
反対にハロゲンは原子半径よりもイオン半径の方が大きくなっています。
これはイオンになる際に電子を一つ受け取ることで軌道が満たされてシールド効果が高まることにより、原子核によって中心に引き付けられる力が弱まるためです。
ハロゲンの列を見ると、イオン半径の大きさの関係は以下のようになっていることがわかります。
F– < Cl– <Br– <I–
イオン半径が小さいということは、電子は狭い範囲に局在化することになります。
電子は広い範囲に散らばって非局在化する方が安定します。
なぜ非局在化すると安定するのか、ということは以下のサイトにまとめらています。
Chem Station ”共役はなぜ起こる?”
今の私のレベルでは上のサイトの説明は難しくて理解できていませんが、
広い範囲に電子が存在できる方が電子の取りうる配置が増えて複雑になるので、物事は乱雑さの増す方向に向かうというエントロピー増大則にのっとっているというふうに直感的に理解しています。
いずれにせよ、電子が局在化して不安定な状態になるので、共役塩基のFイオンは他のハロゲンイオンに比べて不安定です。
よってHFの電離はあまり進まず、弱酸になります。
また残りのHCl、HBr、HIはすべて強酸と書きましたが、上記の理由でその中でも酸性度に差があり、酸性の強い順に以下のようになります。
HI > HBr > HCl
これはハロゲンイオンの大きさの順、
I– > Br– > Cl–
の順と同じになります。
ハロゲン化水素の酸性の強さをまとめると以下のようになります。
ハロゲン化水素と有機化合物との反応
続いてハロゲン化水素が有機化合物とどのように化学反応するかについて見ていきましょう。
ハロゲン化水素とアルケンの付加反応
アルケンは二重結合をもつ炭化水素の総称で、ハロゲン化水素と付加反応を生じやすい物質です。
まずはアルケンの中で最も炭素数が少ないエチレンを代表に、ハロゲン化水素の付加反応を確認しましょう。
エチレンとハロゲン化水素の付加反応
エチレンの二重結合がどのような性質をもつのか、原子軌道から考えてみます。
先ほどまでは便宜上惑星のような原子モデルを使って電子の配置を確認してきましたが、実際には電子はそのように規則正しく並んではおらず、ある瞬間はこの場所、また次の瞬間は別の場所、というように不規則に移動していると考えられています。
その存在確率を元に、K、L、M・・・の殻にさらに細かくs、p、d・・・という軌道があると考えられます。
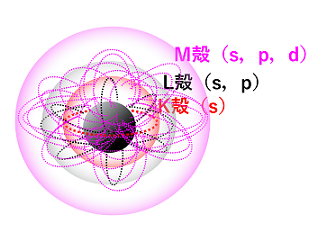
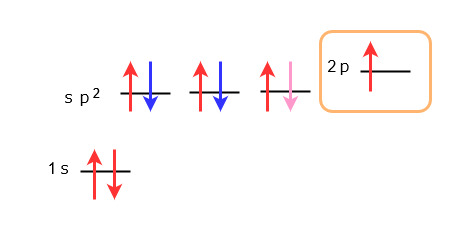
この表し方に基づくと、炭素原子は通常、下図の左側のような原子軌道になっています。
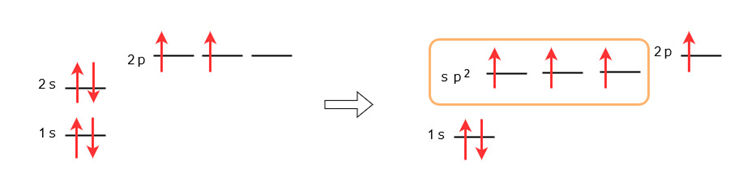
炭素が二重結合によってエチレンになる場合は、結合のために新たにsp2混成軌道という、s軌道とp軌道の間のエネルギー準位をとる3種類の等価な軌道が形成されます。
上図の右側の、オレンジ色の枠で囲んだ部分がsp2混成軌道です。
エチレンの場合は一つのC原子が、2つのH原子と単結合、1つのC原子と二重結合を作っており、下図のような立体構造になります。
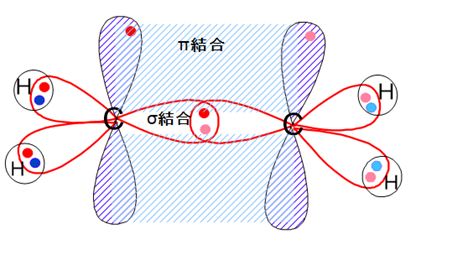
これを先ほどの軌道で表すと、左側の炭素原子の軌道は下図のようになっています。
軌道に入っている矢印で示した電子の色と、立体構造の図に小さなドットで示した電子の色とが対応関係にあります。
炭素間の二重結合は、sp2混成軌道での共有結合によって作られるσ結合と、2p軌道の余った電子によって作られるπ結合との2つでできています。
σ結合は強い結合ですが、π結合は比較的弱い結合です。
π電子はσ結合の上下の面に広がって比較的自由に動けるため、他の分子やイオンとの相互作用によって分極しやすい状態にあります。
そのため、π電子は正電荷をもつ原子に電子を与えて結合を作りやすいのです。
一方、ハロゲン化水素はこれまで確認してきたように分極を生じており、H原子がわずかにプラスの電荷を帯びています。
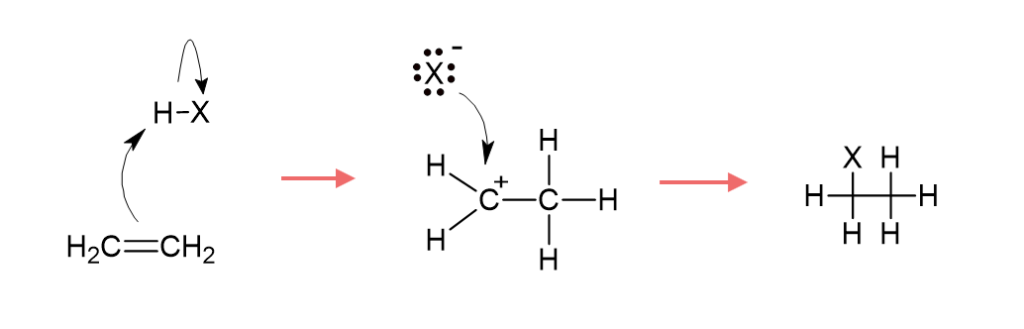
そこでアルケンのπ電子がハロゲン化水素のH原子を求核攻撃します。
すると一方のC原子にH原子が付加してそのとなりのC原子が正電荷を持ち、カルボカチオン(炭素原子上に正電荷を持つ陽イオン)となります。
カルボカチオンは中間体とよばれ、反応経路の途中で生じる化学種です。
ハロゲン化水素の方は、H原子から受け取った電子によって負電荷を帯びたハロゲンイオンが残っており、これがカルボカチオンの正電荷をもつC原子に付加します。
以上の反応は下図のような反応機構で表されます。
この反応のエネルギー変化を表したものが下のグラフです。
上の説明にあてはめると、R=H、Br=Xと読み換えられます。
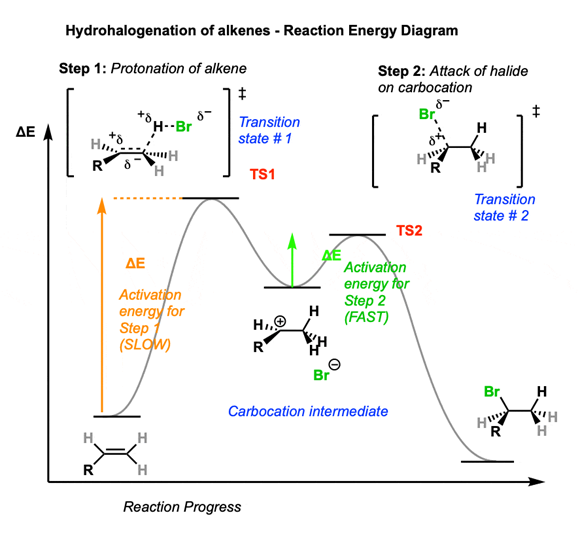
カルボカチオン中間体は二つの山の間の谷に位置しており、反応過程の一時的な安定状態と考えられます。
しかし、エネルギーが高く不安定な状態のため中間体のままで終わりにはならず、また山を越えて最終的な生成物へと変化します。
付加反応とマルコフニコフ則
エチレンへのハロゲン化水素の付加反応ではハロゲンの付加する位置は一通りに決まりましたが、例えばプロペンの場合はどうでしょうか。
ハロゲンが端のC原子に付加する場合と、真ん中のC原子に付加する場合の2通りが考えられますが、どちらになるのでしょうか。
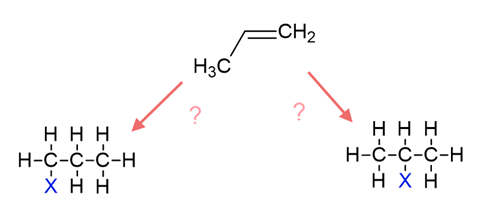
答えは、真ん中のC原子に付加する場合が主生成物(メインで生成される物質)、端のC原子に付加する場合が副生成物となります。
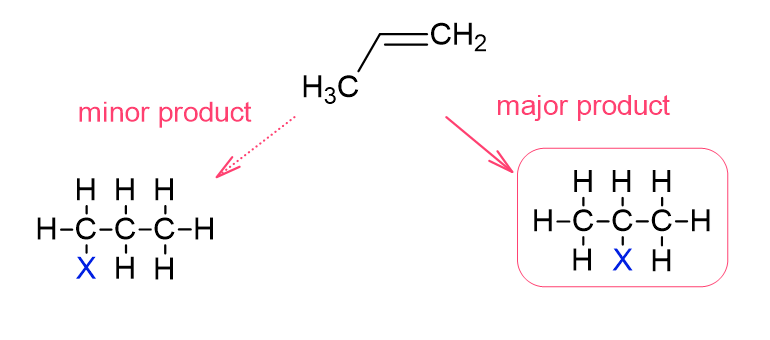
なぜそのような差が生じるかは、エチレンへの付加反応でも出てきたカルボカチオン中間体とエネルギー状態の関係から説明できます。
反応の最初の段階で二重結合のπ電子がハロゲン化水素のH原子に求核攻撃してカルボカチオン中間体が生じますが、カルボカチオンは中心のC原子がいくつのアルキル基と結合しているかによって級数が付けられています。
アルキル基のC原子はH原子よりもわずかに電気陰性度が大きいため(Cの電気陰性度:2.6、Hの電気陰性度:2.2)、C原子の方にほんの少しだけ電子が偏っています。
そのためアルキル基のC原子には電子を押し出す電子供与性があり、正電荷を帯びた中心のC原子に向かって電子を押し出します。
中心のC原子は強い正電荷を帯びているため、周囲のR基から押し出される電子が多くなるほど電荷の偏りが解消されて安定します。
したがって、カルボカチオンは中心のC原子に結合しているアルキル基が多くなるほど安定になります。
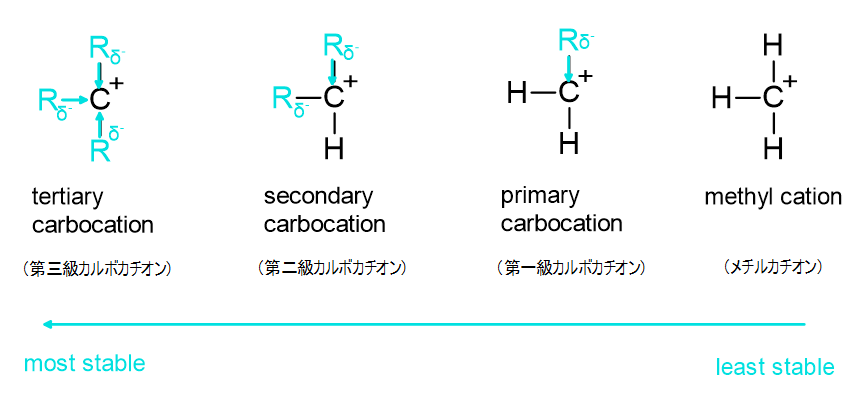
先ほどのプロペンとハロゲン化水素の付加反応の例に戻ると、メインの反応で生じるカルボカチオン中間体は第二級カルボカチオンですが、もう一方でできる中間体は第一級カルボカチオンです。
つまり、メインの反応の方が中間体が安定でエネルギーが低い状態ということになります。
これをエネルギー図で確認すると、下図のようになります。
これはX=Clの例ですが、中間体がエネルギー状態の低い第二級カルボカチオンになる方が、活性化エネルギー(反応が生じるために必要なエネルギー)の山も低くなり、反応が起こりやすくなっていることが読み取れるかと思います。
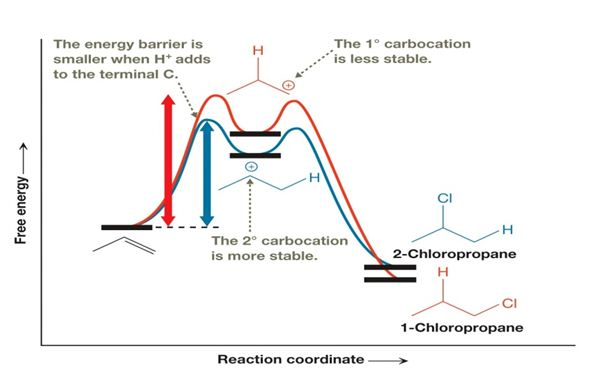
したがって、カルボカチオン中間体が安定な状態を経る反応の方がメインの反応になるというわけです。
このような現象を実験から帰納的に確かめて、原則として導かれたものがマルコフニコフ則(Markovnikov rule)です。
マルコフニコフ則:
二重結合をもつ炭化水素に対し求電子的付加反応をおこなう際、結合する水素原子数の多い方の炭素のほうに、電気的に陽性な原子団が結合する
先ほどのプロペンの例でいうと、結合する水素原子数は、中央のC原子が1個、二重結合でつながったとなりのC原子の方は2個ですので、端のC原子の方が結合する水素原子が多くなっています。
そのため、端のC原子にはHXのうち陽性の方、すなわちH原子が結合するということになります。
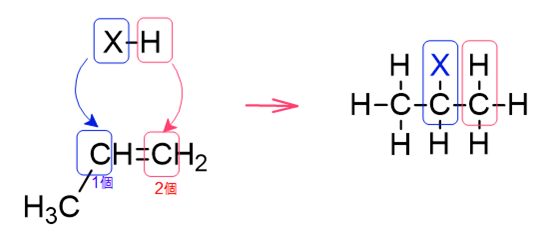
こうしてできる生成物は上で見てきたメインの生成物と同じになりますので、マルコフニコフ則に当てはまることが確認できました。
ハロゲン化水素の反応性の違い
これまではハロゲンを一般的にXと置いて説明してきましたが、実はX=F、Cl、Br、Iのいずれも等価に取り得るわけではありません。
ハロゲンの種類によって反応性は異なり、次のような関係になっています。
ハロゲン化水素と反応性の高さの関係:
HI > HBr > HCl > HF(通常は反応しない)
なぜこのような順番になるかを考えてみましょう。
まずハロゲン化水素とアルケンの結合が生じるには、元々のハロゲンと水素との結合が切れなければなりません。
そこでハロゲン化水素の結合について確認します。
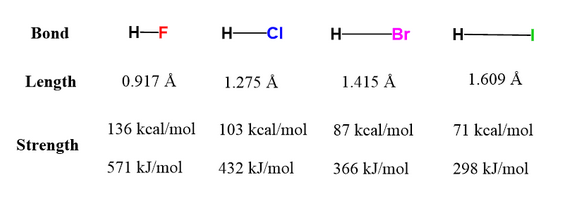
上の図を見ると、ハロゲンの原子番号が大きくなるにつれて結合の長さが長くなり、結合エネルギーが弱くなっていることが読み取れます。
これは原子番号が大きくなるにつれてハロゲンの原子半径が大きくなっているためです。
原子半径が大きくなるほどH原子との距離が離れるため結合の長さは長くなり、H原子と共有している電子がハロゲン原子の原子核から遠いところに位置するため、電子を引き付ける力が弱まります。
そのため、原子番号が大きくなるほど結合エネルギーは小さくなるのです。
改めてハロゲン化水素の結合の強さを順番に整理します。
HF > HCl > HBr > HI
反応性の高さの順とちょうど逆になっていますね。
つまり、元の結合が切れやすいほど反応性に富み、元の結合が強いほど反応しにくいということになります。
よって結合エネルギーの大きなHFはほとんど反応を示さないのです。
ハロゲン化水素とアルコールの置換反応
アルコールとは炭化水素のH原子がOH基に置き換わった物質のことで、OH基がついているC原子が結合しているアルキル基の数によって、一級、二級、三級に分けられます。
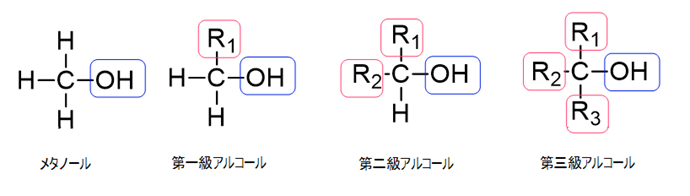
一級・二級・三級アルコールはいずれも、ハロゲン化水素と求核置換反応を起こし、ハロゲン化アルキル(アルカンが持つ水素が1個ハロゲンに置き換わった化合物)を生成します。
ただし、付加反応の例で見たのと同様に、ハロゲンの種類によって反応性には違いがあります。
ハロゲン化水素と反応性の高さの関係
HI > HBr > HCl > HF(通常は反応しない)
また、アルコールの級数によっても反応性の違いがあります。
アルコールの級数と反応性の高さの関係
第三級アルコール > 第二級アルコール > 第一級アルコール
アルコールの級数による反応性の違いは、反応機構から説明ができます。
アルコールの置換反応にはSN1反応とSN2反応という2つの反応機構があります
SN2反応:
中間体を経由しない一段階で進行し、立体反転が起こるのが特徴です。
主に第一級アルコールで見られます。
SN1反応:
カルボカチオン中間体を経由し、ラセミ化が起こりやすくなります。
主に第二級・第三級アルコールで見られます。
“SN” とは求核置換反応(nucleophilic substitution)のことです。
その後ろの”1″ は律速段階の反応に関わる分子が単分子であることを意味します。
“2” は律速段階の反応に関わる分子が2分子であることを意味します。
律速段階とは、反応全体の速度を決める、最も速度の遅い反応のことです。
エネルギー図で表すと次のようになります。
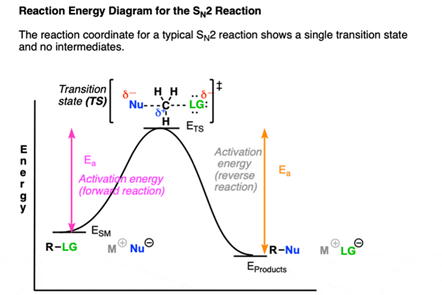
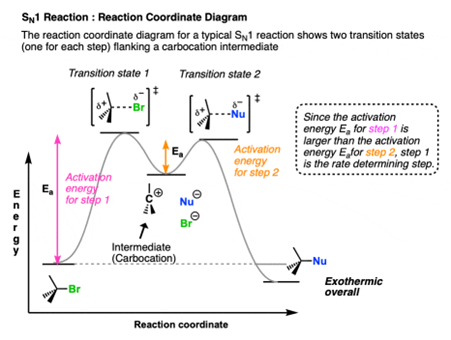
LGは “Leaving Group”(脱離基)の略、
Nuは “Nucleophile”(求核剤)の略、
SMは “Starting Material”(出発物質)の略、
TSは “Transition State”(遷移状態)の略、です。
‡は遷移状態を示す記号です。
では、第一級アルコールから第三級アルコールまでそれぞれの反応機構を確認してみましょう。
第一級アルコールとハロゲン化水素の置換反応(SN2反応)
第一級アルコールとハロゲン化水素の置換反応は以下のように進行します。
1. OH基のプロトン化
アルコールのO原子は非共有電子対を持っているため、ハロゲン化水素の正電荷を持ったH原子を受け取ってプロトン化します。
するとO原子は正電荷を帯び、隣のC原子から電子の供与を受けます。
電子を供与したC原子はわずかに正電荷を帯びます。
2. ハロゲンの求核攻撃とOH基の脱離
わずかに正電荷を帯びたC原子に、ハロゲンがOH基の背面から求核攻撃をします。
この攻撃と同時にプロトン化したH2Oが脱離します。
第一級アルコールはC原子に結合しているアルキル基の数が少なく立体的に邪魔になるものが少ないため、求核剤であるハロゲンが背面から攻撃しやすいのです。
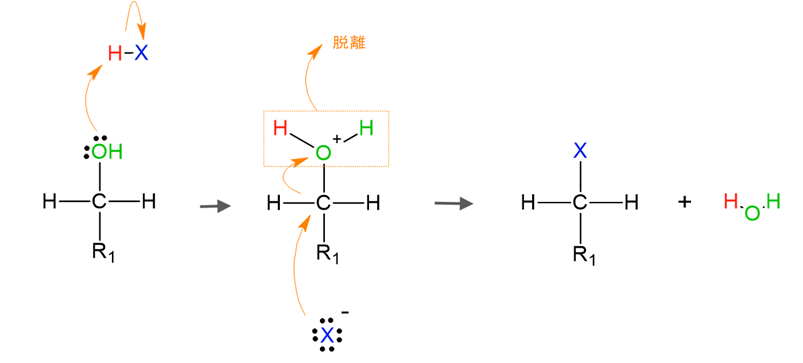
こうしてOH基とハロゲンが置換されたハロゲン化アルキルが生成されます。
この反応ではカルボカチオン中間体は形成されず、ハロゲンの求核攻撃とプロトン化してH2OになったOH基の脱離とが同時進行します。
このように中間体を経由しない反応を協奏反応といいます。
第二級アルコールとハロゲン化水素の置換反応(SN1反応)
第二級アルコールとハロゲン化水素の置換反応は以下のように進行します。
1. OH基のプロトン化
アルコールのO原子は非共有電子対を持っているため、ハロゲン化水素の正電荷を持ったH原子を受け取ってプロトン化します。
するとO原子は正電荷を帯び、隣のC原子から電子の供与を受けます。
ここまでは上で見た第一級アルコールの場合と同じです。
2. OH基の脱離とカルボカチオン中間体の形成
プロトン化してH2OになったOH基が脱離します。
これにより強い正電荷を帯びたカルボカチオン中間体が形成されます。
3. ハロゲンの求核攻撃
カルボカチオン中間体にハロゲンが求核攻撃をします。
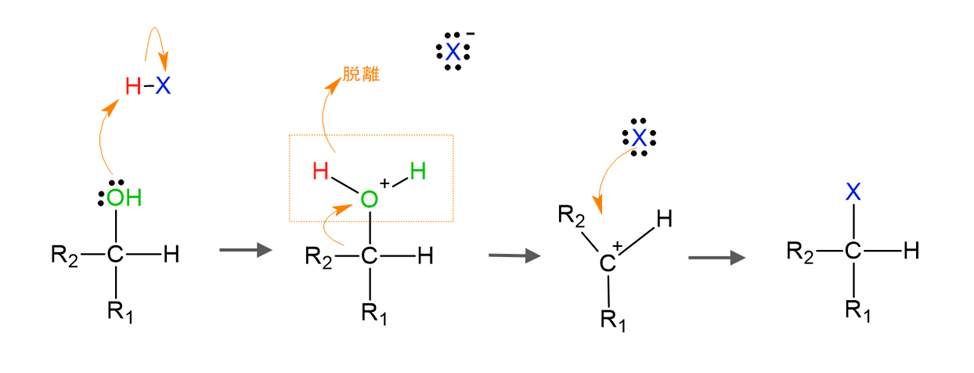
こうしてOH基とハロゲンが置換されたハロゲン化アルキルが生成されます。
先ほどの第一級アルコールのSN2反応では、ハロゲンは背面からしか求核攻撃ができないため、必ず立体反転が生じました。
もし第二級・第三級アルコールでもSN2反応のように背面からしか求核攻撃ができないとなると、アルキル基による立体障害で反応が難しくなってしまいます。
一方、この反応SN1反応ではカルボカチオン中間体が平面構造をとるため、求核剤は両面からの攻撃が可能です。
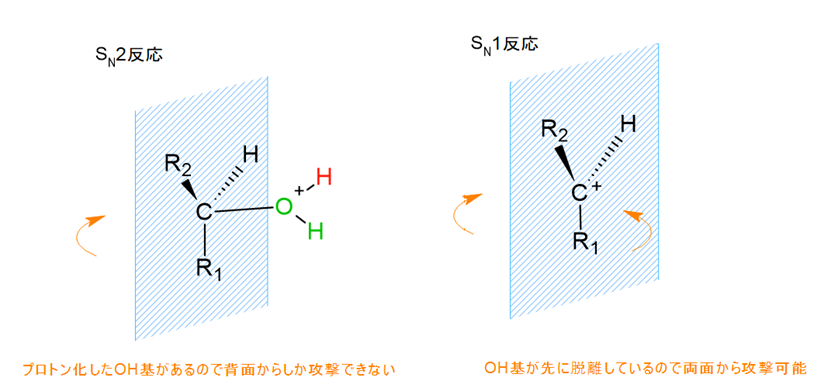
両面からの攻撃が可能になることで、ラセミ化(鏡像関係にある異性体が同じ割合で生成されること)が起こりやすくなります。
第三級アルコールとハロゲン化水素の置換反応(SN1反応)
第三級アルコールの基本的な反応機構は第二級アルコールの場合と同じです。
異なる点は、
第二級アルコールの場合はカルボカチオン中間体が第二級カルボカチオンになるのに対し、
第三級アルコールの場合は第三級カルボカチオンになるという点です。
付加反応のところで説明したようにカルボカチオン中間体は級数が多い方が安定します。
したがって、第三級アルコールの反応が最も生じやすいということになります。
アルコールとハロゲン化水素の反応:まとめ
アルコールとハロゲン化水素の求核置換反応をまとめると次のようになります。
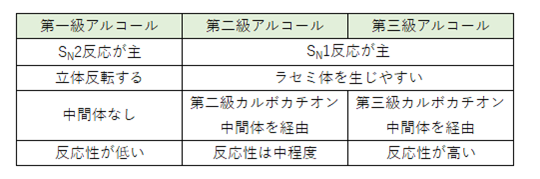
第一級アルコールでSN2反応が起こりやすい理由は以下の2つです。
・立体障害が小さいため、求核剤が背面から攻撃しやすい
・安定なカルボカチオン中間体が作れない
第二級・第三級アルコールでSN1反応が起こりやすい理由は以下の2つです。
・立体障害のため、SN2反応が起こりにくい
・カルボカチオン中間体が比較的安定している
SN2反応では立体反転が起こり、SN1反応ではラセミ化が生じやすいと書きました。
このような光学異性体(鏡像関係にある異性体)の区別は薬学の分野で特に重要になります。
光学異性体のうち、時計回りに配置しているものをD体、反時計回りのものをL体といいます。
不思議なことですが、生体の重要な構成成分であるアミノ酸はL体のみ、糖はD体のみが存在します。
そのため薬用成分も光学異性体によって生体との相互作用が異なるため、薬の合成過程においてSN1反応が起きるかSN2反応が起きるかという点が重要になるのです。
8/15(木)学習時間:5.75H
・岡野の化学(205)
・昇華性の錠剤に関する特許を読了
その他
・4000 プロとして仕事を獲得することの重要性
・2900 CV作成の第一歩
8/16(金)学習時間:11.25H
・岡野の化学(206)(207)
・ハロゲンについてまとめ(途中まで)
その他
・2037 CV作成とマインドマップ
・2561 得意分野をCVに書けるまでブレイクダウンする
・1675 トライアルのお作法
8/17(土)学習時間:14H
・岡野の化学(208)途中まで
・ハロゲンについてまとめ








コメントを残す