岡野の化学で緩衝液について学習したので関連する特許を調べていたところ、腸溶性錠剤に関する特許が見つかりました。
前提となる知識が足りていないので特許の内容に入る前に、腸溶性錠剤とはどんなものでどのように作られるのか、緩衝液がどのように関係するのか、という点を調べました。
薬剤の種類
薬のタイプには色々なものがありますが、腸溶性錠剤はその中でどこに位置しているのでしょうか。
ごく簡単に薬剤の分類をマインドマップにしてみました。
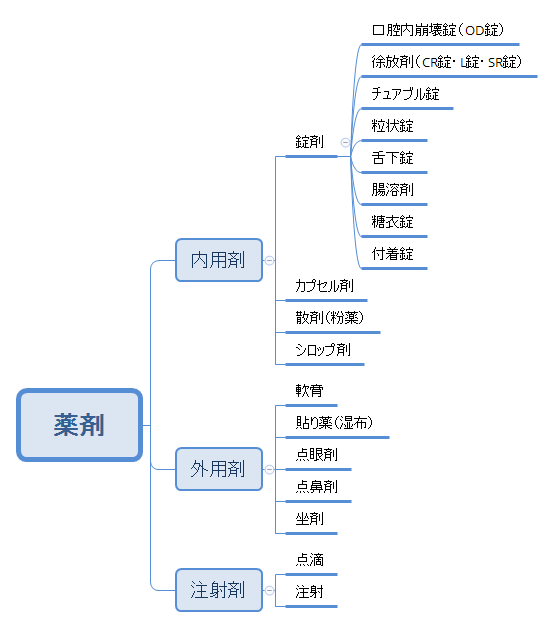
まず薬のタイプは大きく分けると、次の3つに分けられます。
内用剤(口から飲む薬)
外用剤(皮膚に塗ったり、目や鼻に点したりする薬)
注射剤(注射針で皮膚の下や血管に注入する薬)
さらに内用剤にはカプセルやシロップなどのタイプがあり、その中でも最も一般的に使われているのが錠剤です。
錠剤の中にもさらに種類があります。
OD錠:口に入れると唾液ですぐに溶け、水なしで飲める薬。
ODは「口の中(Oral)で崩壊する(Disintegration)」の意味。
徐放剤:ゆっくりと溶けて効果が長時間持続する薬。
CR錠(Controlled:コントロール + Release:放出する)、
L錠(Long:効果が長く続く)、
SR錠(Sustained:持続して + Release:放出する)、とも呼ばれる。
チュアブル錠:噛み砕いて唾液で溶かす薬。
舌下錠:舌の下に薬を入れて溶かし、吸収する薬。
糖衣錠:糖でコーティングして苦みを抑え、飲みやすくした薬。
粒状錠:薬の成分が多くてなかなか小さくできない錠剤を、粒状にして飲みやすくした製剤。
顆粒よりは大きなサイズ。
付着錠:口の中に貼り付けて効果を持続しやすくした薬。
腸溶剤:胃では溶けずに腸で溶けるようにした薬。
この中の腸溶剤について、取り上げます。
腸溶性錠剤とは
改めて腸溶性錠剤(腸溶剤)とは、
錠剤の周りを糖や高分子のフィルムで覆い、胃では溶けずに腸で溶けるようにした錠剤です。
胃は通常pH1~2の強い酸性環境です。
通常の薬では胃酸によって有効成分が溶け出して本来の効果を発揮できなかったり、胃を荒らしたりする場合があります。
そのような薬を高分子でコーティングすることにより、胃では溶けずに腸で溶けるようにしたものが腸溶性錠剤です。
胃が強酸の環境だったのに対し、小腸は中性~弱アルカリ性です。
このpHの違いを利用して、pHにより溶解性の異なるコーティングを施すことで錠剤の溶けやすさを変化させているのです。
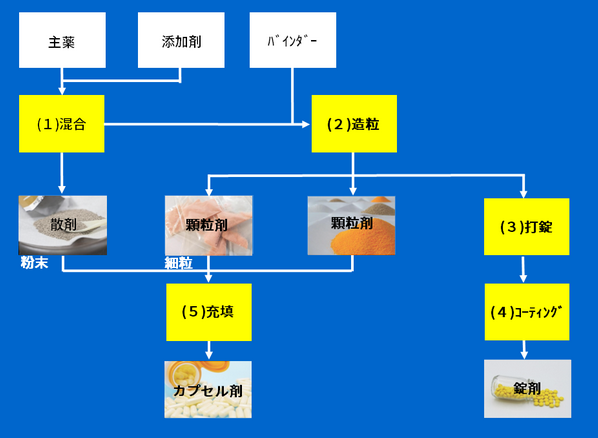
錠剤の成型プロセス
腸溶剤を含め、錠剤がどのように成型されていくのかを見ていきましょう。
主に以下の工程があります。
①秤量
②造粒
③混合
④打錠
⑤コーティング
①秤量:
原薬や添加剤をふるいにかけたり粉砕したりしたのち、規定の量をはかり取ります。
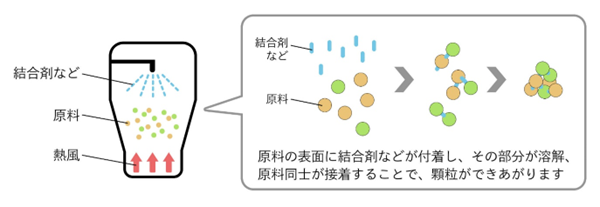
②造粒:
秤量後の粉末状のままだと、その後のプロセスで粉が飛散したり、正確に量りにくくなったりしてしまいます。
そのため、粉末に結合剤を加えて高速攪拌機で攪拌し、扱いやすい顆粒の状態にします。
この工程を「造粒」といいます。
粒径が100μm以下のものを粉、0.1mm~数mmのものを粒と呼ぶのが一般的なようです。
結合剤は原料の粉体粒子同士を結びつけて扱いやすい粒状の大きさにするとともに、錠剤の強度を高める働きをします。
ヒドロキシプロピルセルロース、結晶セルロース、ポリビニルピロリドンなどが使われます。
造粒した直後はまだ濡れている状態なので乾燥させて仕上げます。
③混合:
原薬と添加剤が均一になるように、造粒後の顆粒をコンテナで混ぜ合わせます。
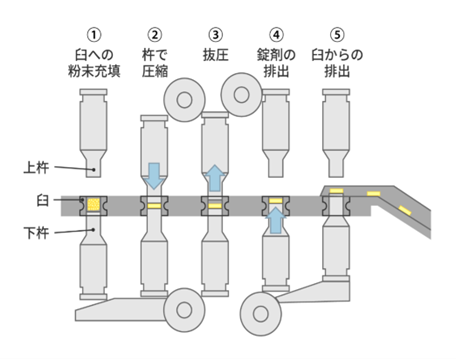
④打錠:
均一に混ぜ合わせた顆粒を打錠機に入れ、臼と杵を使って粉末に圧力を加え、押し固めます。
⑤コーティング:
苦みがある場合、溶けやすい場合などは、必要に応じて高分子のフィルムでコーティングします。
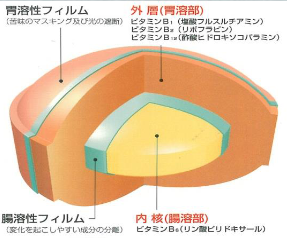
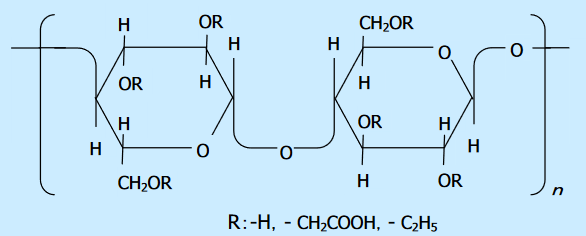
腸溶性錠剤の場合は、胃のpHでは溶けずに腸のpHで溶けるコーティング基材として、例えばカルボキシメチルエチルセルロース(CMEC)が使われています。
カルボキシメチルセルロースは、セルロースのOH基に部分的にカルボキシメチル基とカルボキシエチル基がエーテル結合した化合物です。
下のグラフは、横軸が溶液のpH、縦軸がCMECコーティングした錠剤が崩壊するまでに要する時間を表しています。
pHが小さいとき(酸性条件)には崩壊するまでに長い時間を要しますが、pHが大きいとき(アルカリ性条件)では崩壊するまでの時間が短くなっていることが読み取れます。
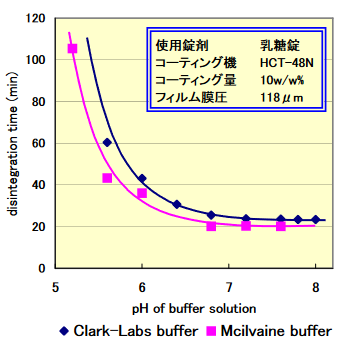
これは、CMECが弱酸性を示すカルボキシ基(-COOH)を持つためです。
カルボキシ基は弱酸性のため、pHが小さく酸性が強い条件下では電離が進まないため溶解が進行せず、崩壊性が低くなります。
一方でpHが大きなアルカリ性条件下では電離が進み、崩壊しやすくなります。
以上は錠剤の成型プロセスでしたが、
結合剤を入れずに原薬と添加材を混合するプロセスで終われば散剤、
造粒で終われば顆粒剤、
造粒後にゲル錠のカプセルに充填すればカプセル錠、
にそれぞれ成型できます。
添加剤の種類
上でみてきた製造工程の最初に「原薬」と「添加剤」という言葉が出てきましたが、製剤は原薬と添加剤で構成されています。
薬物が生体の生理機能に影響を与えることを薬理作用といい、医薬品などに含まれる成分のうち、目的の薬理作用を生じさせる素となる成分のことを有効成分といいます。
例えば、解熱鎮痛剤であれば解熱・鎮痛の効果を生じる素となるアスピリンが有効成分です。
製剤のうち有効成分を原薬といい、原薬に添加剤が加えられて製剤となります。
添加剤の例としては以下のものがあります。
賦形剤:
有効成分が少ない場合に、取り扱いに適した量に増量するために加えるものです。
主薬の量には関係なく、錠剤はおおむね直径6~10mmに作られています。
これは、秤量プロセスや打錠プロセスで臼の中に粒子を量りとる際に、大きな量に規定したが相対的に精度が高くなるためです。
例えば、規定量が30mgのときに3mgの誤差があれば10%の差に相当しますが、規定量が300mgのときに同じく3mgの誤差があっても1%の差に抑えられます。
賦形剤の原料としては、生体機能に影響を与えない乳糖(ラクトース)やデンプンが使われます。
崩壊剤:
体内の水分を吸収して膨張するなどして錠剤を崩壊させ、有効成分を放出しやすくするために加えられます。
カルメロースカルシウム、カルボキシメチルセルロースなど、親水基をもつセルロース類がよく使われます。
滑沢剤:
錠剤の原料となる粉末や顆粒に少量を加えることで、粉体同士の付着力を弱めて粉体の流動性を増すものです。
例えば、打錠プロセスで粉体が臼や杵に付着するのを防ぐなどの効果があります。
ステアリン酸マグネシウム(Mg(C18H35O2)2)、タルク(含水珪酸マグネシウム(Mg3Si4O10(OH)2))などが使われます。
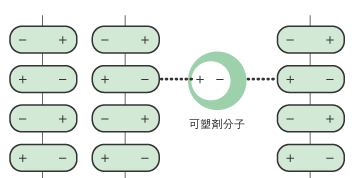
可塑剤:
フィルムコーティングの柔軟性を向上させ、割れやはがれを防ぐために加えられます。
多くは酸とアルコールの脱水縮合によって生じるエステルで、クエン酸トリエチルなどが使われます。
可塑剤は、酸由来の極性部分と、アルコールのアルキル鎖に由来する非極性部分から成ります。
フィルム材料となるポリマー分子同士の間に入り込んで極性部分でポリマー分子と結びつくとともに、非極性部分によって他のポリマー分子との距離を広げます。
このため、分子同士がくっついて固まることなく、軟らかい状態を保てます。
崩壊試験法
腸溶性錠剤の効果を検証するために、崩壊試験法というものが行われます。
崩壊試験法は日本薬局方で定められた条件において、錠剤が規定時間以内に崩壊するかどうかを確認する試験方法です。
日本薬局方とは、医薬品の性状及び品質の適正を図るため、厚生労働大臣が薬事審議会の意見を聴いて定める公定文書です。
医薬品の規格基準や標準的な試験法が示されています。
腸溶性錠剤の場合は、日本薬局方の崩壊試験法により、次の二段階の試験を行うことと定められています。
6.09 崩壊試験法(参照ページ:https://www.pmda.go.jp/files/000263727.pdf)より
1.2.2. 腸溶性製剤
別に規定するもののほか,崩壊試験第1液及び崩壊試験第2液による二つの試験を別々に行う.
1.2.2.1. 腸溶錠及び腸溶性カプセル剤
(ⅰ) 崩壊試験第1液による試験:
試験液に崩壊試験第1液を用いて120分間,即放性製剤の操作法に従って試験を行う.
腸溶錠及び腸溶性カプセル剤が崩壊した場合,又は腸溶性皮膜が開口,破損した場合,崩壊したものとする.
全ての試料が崩壊しない場合,適合とする.
1個又は2個が崩壊した場合は,更に12個の試料について試験を行い,計18個の試料のうち16個以上の試料が崩壊しない場合,適合とする.
(ⅱ) 崩壊試験第2液による試験:
試験液に崩壊試験第2液を用いて60分間,即放性製剤の操作法に従って試験を行い,崩壊の適否を判定する.
使用される溶液は以下になります。
崩壊試験第1液:
塩化ナトリウム 2.0g に塩酸 7.0mL および水を加えて1,000mLとした溶液。
無色澄明で、その pH は約 1.2 である。
崩壊試験第2液:
0.2mol/L りん酸二水素カリウム試液 250mL に 0.2mol/L 水酸化ナトリウム試液 118mL および水を加えて 1,000mL とする。
無色澄明で、その pH は約 6.8 である。
崩壊試験第1液による試験
崩壊試験第1液による試験は耐酸試験と考えることができます。
腸溶性錠剤は胃で溶けてはいけないため、胃酸と同じpHの実験環境を作り出して、そこで錠剤が崩壊しないということを確認するための試験です。
この試験で使われる崩壊試験第1液には緩衝作用がありません。
あえて緩衝液を使わずに、空腹時の最もpHが小さく酸性条件の厳しい状況下に設定しておいて、それでも錠剤が崩壊しないということを確認するためと考えられます。
崩壊試験第1液とは異なりますが、pH=4.5程度の酢酸緩衝液を使って耐酸試験をする場合もあります。
この場合は食後の胃の状態に近い比較的穏やかな環境での崩壊性を確認します。
崩壊試験第2液による試験
第1試験の場合は胃の環境を想定して錠剤が崩壊しないことが求められましたが、
第2試験では腸内環境を想定したpH環境を作り、その中で錠剤が適切に崩壊するかを確認します。
この試験で使われる崩壊試験第2液には、
KH2PO4(リン酸二水素カリウム)とNaOHが使われています。
リン酸は以下の3段階で電離します。
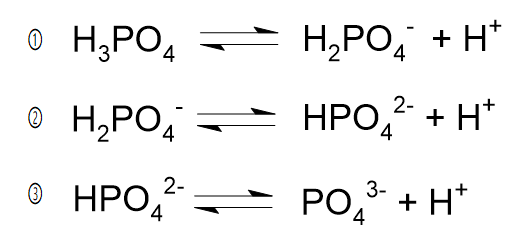
①~③の平衡定数をそれぞれK1、K2、K3とおくと、K1>K2>K3が成り立ちます。
したがって、①の電離が最も起こりやすく、②はその次、③の電離は起こりにくい、ということになります。
リン酸二水素カリウムの電離は、以下のように生じます。
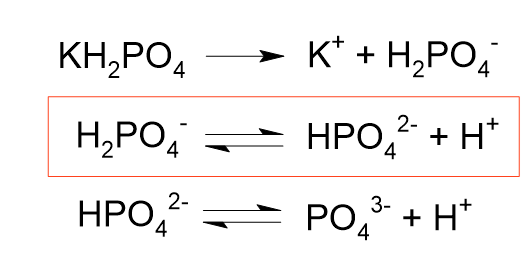
この時、赤枠で囲んだ反応は二段階目の電離になるため電離度は小さいです。
ここで、NaOHの存在を考えます。
NaOHは強塩基のためほぼ100%電離してOHイオンを生じます。
OHイオンは上の赤枠の反応で生じるHイオンを奪うため、ルシャトリエの原理により赤枠の電離反応が通常よりも進みます。
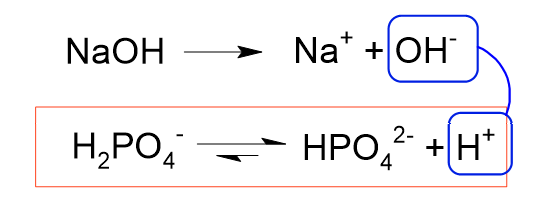
よって、この溶液中にはHPO42-も多く存在します。
崩壊試験第2液は緩衝液として機能します。
どのようにpHを抑える働きをするのか、酸と塩基を加えた場合でそれぞれ考えてみます。
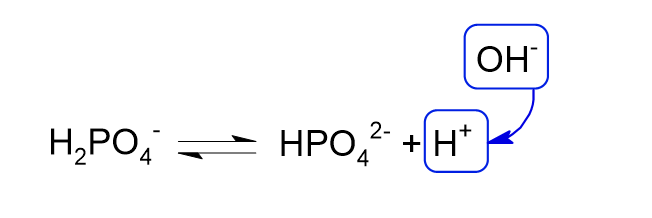
塩基を加えた場合
塩基を加えると溶液中にOHイオンが増えます。
このOHイオンは、KH2PO4の二段階目の電離で生じるHイオンと結びついて水分子となって消費されます。
緩衝液の中で消費されたHイオンは、ルシャトリエの原理により、それを打ち消す形で平衡が右に傾いてH2PO4–の電離が進みます。
結果として溶液のpHはほとんど変化しません。
酸を加えた場合
酸を加えると溶液中にHイオンが増えます。
このHイオンは、NaOHの影響で多量に生じたHPO42-と反応してH2PO4–になります。
結果としてH2PO4-が増えるので、ルシャトリエの原理によりそれを打ち消すようにKH2PO4の二段階目の電離が進みますが、二段階目であるためにわずかしか電離しません。
そのためHイオンはほとんど増えず、溶液全体のpHの変化を抑えることができます。
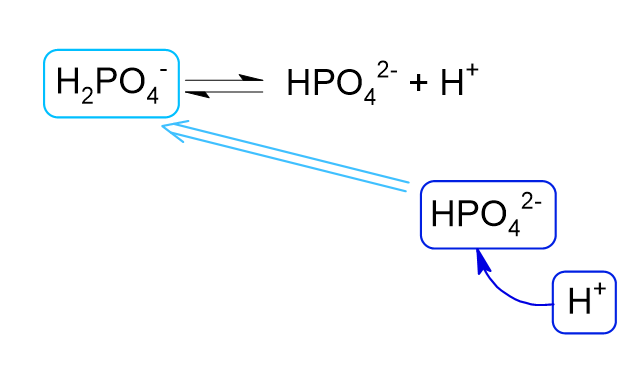
このような緩衝作用は小腸の中でも実際に起こっているため、崩壊試験第2液による試験では腸の緩衝作用が働いた穏やかな環境できちんと錠剤の崩壊が起きるかを確認するものと思われます。
参考)
・太陽薬局 ”錠剤について” https://www.taiyo55.co.jp/report/report_category11/report68.html (参照2024-08-05)
・玉寄クリニック “【意外と知らない】錠剤の種類” https://tamayose-cl.jp/blog/%E3%80%90%E6%84%8F%E5%A4%96%E3%81%A8%E7%9F%A5%E3%82%89%E3%81%AA%E3%81%84%E3%80%91%E9%8C%A0%E5%89%A4%E3%81%AE%E7%A8%AE%E9%A1%9E%E3%80%90%E5%8C%BB%E5%B8%AB%E7%9B%A3%E4%BF%AE%E3%80%91(参照2024-08-05)
・野口泰男「賦形薬の進歩」 ファルマシア Vol.3, No.9, 1967
・中外製薬 ”原薬製造・固形剤のくすり工場” https://www.chugai-pharm.co.jp/ptn/medicine/factory/factory001_006.html(参照2024-08-04)
8/4(日)学習時間:8.75H
・岡野の化学(188)~(189)
・リン酸緩衝液の原理について
その他)
・0965 情報の自動収集とcv改訂
・2171 cv作成に関するQ&A
前回求人情報を調べてから2か月ほど経過したので定期チェック。
Webページのチェックを自動化していなかったのでDiffBrowserというソフトをインストールして設定した。
8/5(月)学習時間:5.25H
・腸溶性錠剤に関する特許の全体を流し読み、前提となる知識を確認
課題)
・調べた知識を踏まえて、腸溶性錠剤に関する特許の内容を説明できるようにする









コメントを残す