岡野の化学で緩衝液について学習したので、その原理についてまとめます。
緩衝液とは
緩衝液とは、外部から少量の酸や塩基を加えた場合にpHの変化を和らげる働きをする溶液を指します。
バッファーとも呼ばれます。
緩衝とは衝撃を和らげるということです。
pHは常用対数を使ってHイオン濃度を表したもので、pHが1変化すると、Hイオン濃度は10倍変化することになります。
そのため、pHの変化が与える影響は非常に大きな衝撃となるのです。
例えば、生体内の環境や、細胞・微生物の培養、クロマトグラフィーの移動相、電気泳動の溶媒といったpHの変化に影響を受けやすいところには緩衝液が必要となります。
「少量」という点は注意が必要で、大量に加えると変化を抑えきれません。
また、緩衝液によってpHが全く変化しなくなるわけではなく、あくまでも変化を和らげる、ということです。
多くの場合、次の二種類が緩衝液として使われます。
①弱酸+その塩
②弱塩基+その塩
①の例としては、
酢酸と酢酸ナトリウムの混合溶液
(弱酸=酢酸、その塩=酢酸ナトリウム)
②の例としては、
アンモニアと塩化アンモニウムの混合溶液
(弱塩基=アンモニア、その塩=塩化アンモニウム)
が挙げられます。
塩とは
弱酸(弱塩基)とその塩、と書きましたが、塩(えん)とは何だったか、復習します。
塩とは、酸と塩基の反応によって作られる生成物です。必ずしも水の生成を伴いません。
酸と塩基には代表的な3つの定義(アレニウスの定義、ブレンステッド・ローリーの定義、ルイスの定義)があります。
①の酢酸ナトリウムは、アレニウス酸・塩基の塩といえます。
アレニウス酸・塩基の定義:
アレニウス酸:水に溶けると水素イオンH+を生じる物質
アレニウス塩基:水に溶けると水酸化物イオンOH-を生じる物質
アレニウス酸とアレニウス塩基を反応させると、必ず塩と水が生じます。
①ではアレニウス酸の酢酸と、アレニウス塩基の水酸化ナトリウムが中和反応し、塩である酢酸ナトリウムと水が生じます。

②では塩化アンモニウムが塩にあたりますが、
アンモニアから直接OHイオンは出てきませんので、アンモニアはアレニウス塩基とは言えません。
ただし、ブレンステッド・ローリーの以下の定義にあてはまるので、ブレンステッド塩基として定義されます。
ブレンステッド・ローリーの酸・塩基の定義:
ブレンステッド酸:水素イオンH+を与える物質
ブレンステッド塩基:水素イオンH+を受け取る物質
よってブレンステッド塩基のアンモニアとブレンステッド酸の塩酸が反応して、塩である塩化アンモニウムが生じます。
この場合は水は生成されません。
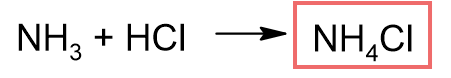
緩衝液の原理
上に挙げた2種類の緩衝液がどのようにしてpHの変化を和らげるのか、以下で見ていきます。
酢酸と酢酸ナトリウムの混合溶液
酢酸と酢酸ナトリウムの混合溶液では、以下の電離が起きています。
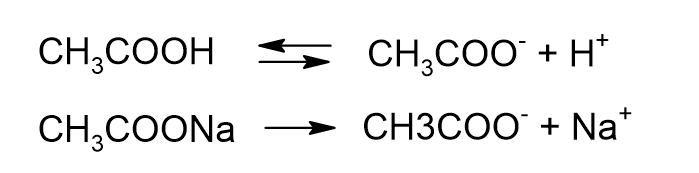
酢酸ナトリウムの電離度はほぼ100パーセントです。
水溶液中には酢酸ナトリウムの形ではほとんど存在せず、イオンに分かれているということです。
一方、酢酸の電離度は1%程度で、水溶液中での電離はごくわずかです。
99%は酢酸のままで存在しているということになります。
酢酸の電離の式には、左向き・右向き両方の矢印が書いてあります。これは電離が平衡状態にあることを表しています。
つまり、右向きの反応と左向きの反応が両方とも起こる可逆反応であり、平衡状態ではそれぞれの反応速度が等しくなっていて、見かけ上反応が止まっているように見えます。
ところで酢酸の電離を上の式で書きましたが、実際には水溶液中では水分子が水素イオンを受け取ってヒドロニウムイオンになる反応も起きていますので、下図のように書くのが正確です。
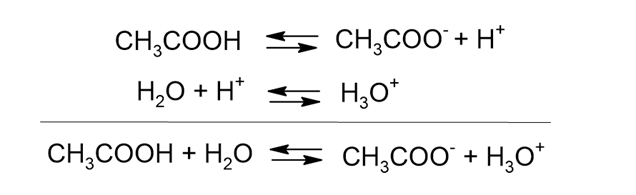
ただし、すべてのHイオンは水分子とくっついてヒドロニウムイオンになるので、通常はヒドロニウムイオンの存在は書かずにHイオンに置き換えて表記します。
さて、この緩衝液に酸を加えた場合と塩基を加えた場合とで、それぞれどのような反応が生じるかを見ていきます。
塩基を加えた場合
塩基を加えた場合、水溶液中にOH–が増えます。
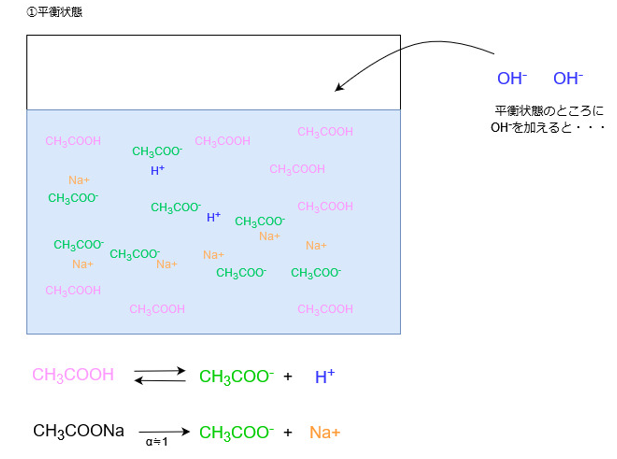
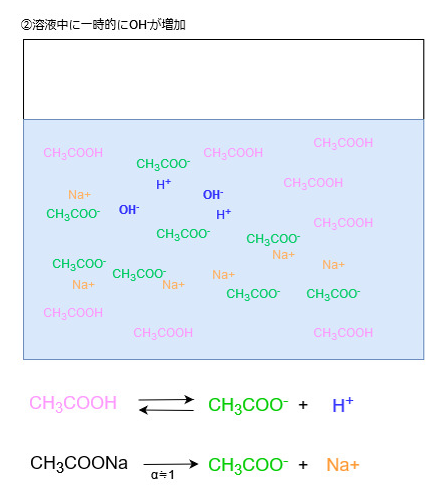
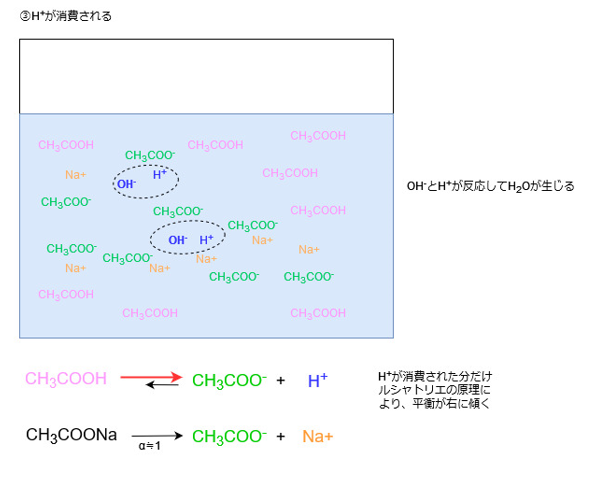
OH–は水溶液中に電離しているH+と反応してH2Oになります。
この際、水溶液中からH+が消費されてH+の濃度が小さくなります。
ここまでだと、水溶液中のH+濃度が小さくなっているのでpHが大きくなるのではないかと思うかもしれませんが、ここでルシャトリエの原理が働きます。
ルシャトリエの原理:
平衡状態にある系の温度・圧力・濃度を変化させると、それを打ち消すような方向に平衡が傾く
つまり、溶液中からH+濃度が小さくなった分だけ、それを補うように酢酸の電離が進み、H+が新たに生じます。
電離していない酢酸は水溶液中にたくさん存在するので、OH–が追加されればまた同じ反応が繰り返し起こります。
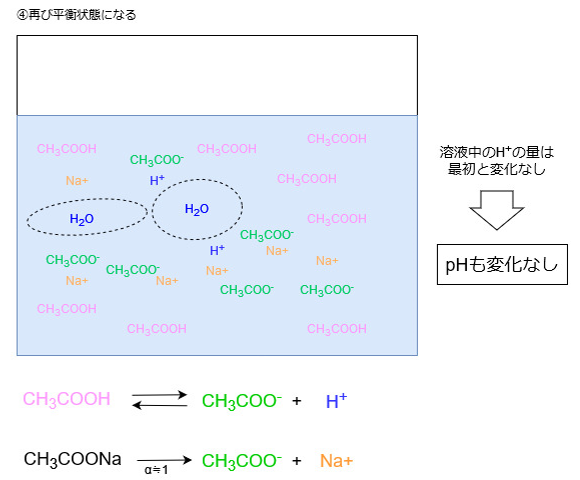
結果として溶液中のHイオン濃度はほとんど変化しません。
pHは一般的には次の式で定義されます。
pH = -log[H+]
厳密にはさらに活量というものが関係します。
活量とは簡単に言うと個々の水素イオンがどれくらい自由に動けるかを表したものです。
濃度が高く水素イオンがたくさん存在する場合は水素イオン同士がぶつかりやすくなりますので、個々の水素イオンが自由に動ける範囲は少なくなります。
今回は水素イオン濃度が小さい弱酸の水溶液の話をしているため、水素イオンの活量による影響は大きくありません。
そのため上の式で考えて差し支えありません。
[H+]はHイオンのモル濃度(mol/L)を表しますので、Hイオン濃度が変化しなければ溶液のpHも変化しないということになります。
酸を加えた場合
酸を加えた場合、溶液中にH+が増えます。
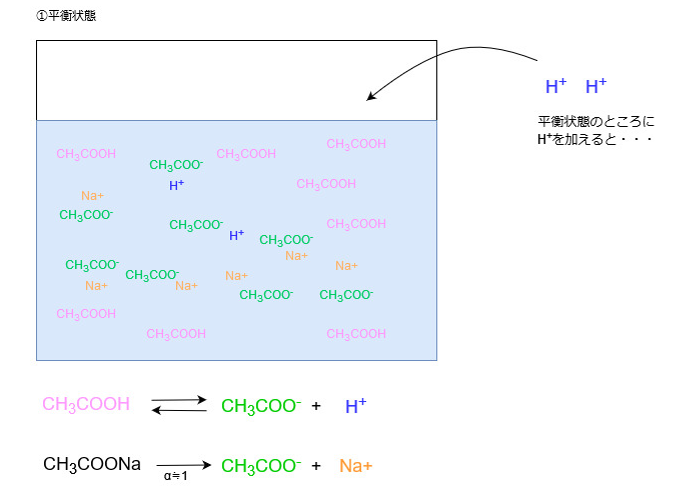
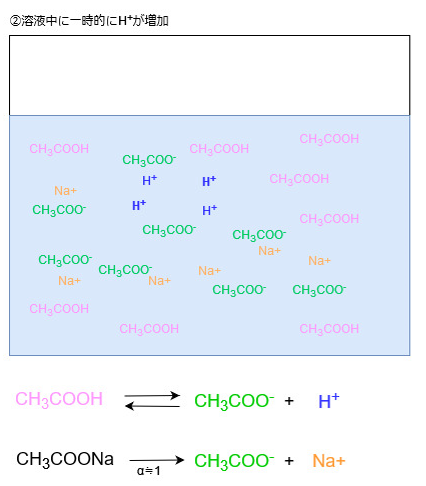
ルシャトリエの原理により、Hイオン濃度が増えた分だけ、それを減らす方向に平衡が傾くため、増えたHイオンは酢酸イオンと反応します。
といっても、酢酸の電離度は非常に小さいので、Hイオンのほとんどは酢酸ナトリウムの電離によって生じた酢酸イオンと結びつきます。
酢酸ナトリウムは電離度1(ほぼ100%電離する)ですので、酢酸イオンは溶液中に大量に存在します。
よって、比較的多くのHイオンと結びつくことができます。
Hイオンと酢酸イオンが反応すると酢酸が増えますので、今度は溶液中の酢酸の濃度が高くなります。
すると再びルシャトリエの原理により、酢酸を減らす方向に、つまり酢酸が電離する方向に平衡が傾きます。
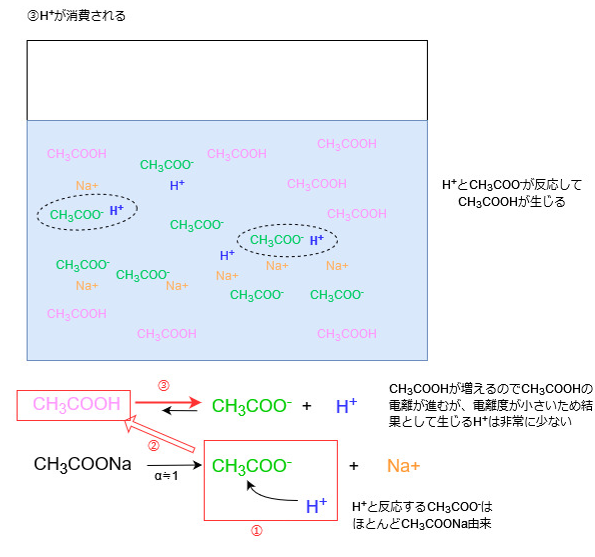
ただし、酢酸の電離度は非常に小さいため、この結果生じるHイオンはごくわずかです。
よって系全体でみると、外部から加えられた多数のHイオンをごくわずかのHイオンに変えたことになり、溶液中のHイオン濃度は最初とほとんど変化しません。
Hイオン濃度が変化しないということは、pHもほとんど変化しません。
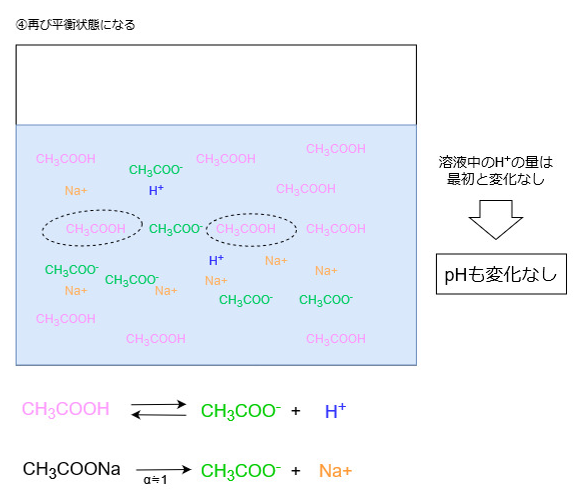
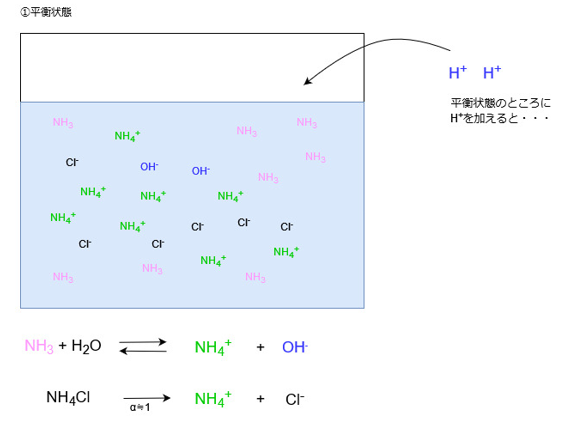
アンモニアと塩化アンモニウムの混合溶液
続いてアンモニアと塩化アンモニウムの混合溶液の場合を見ていきます。
アンモニアと塩化アンモニウムは水中でそれぞれ次のように反応します。
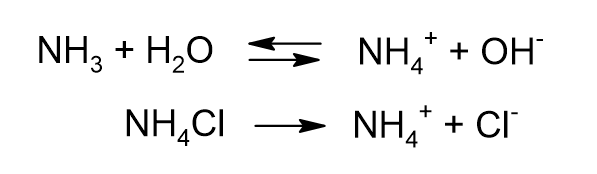
アンモニアは弱塩基ですので、酢酸の場合と同様、水溶液中でわずかしか電離しません。
一方、アンモニウム塩はほぼ100%電離します。
では、酸と塩基を加えた場合で緩衝液がどのように作用するかを見ていきます。
酸を加えた場合
酸を加えた場合、水溶液中にH+が増えます。
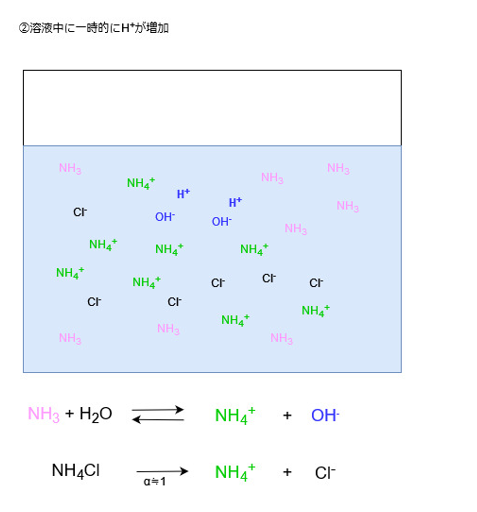
H+は水溶液中に電離しているOH–と反応してH2Oになります。
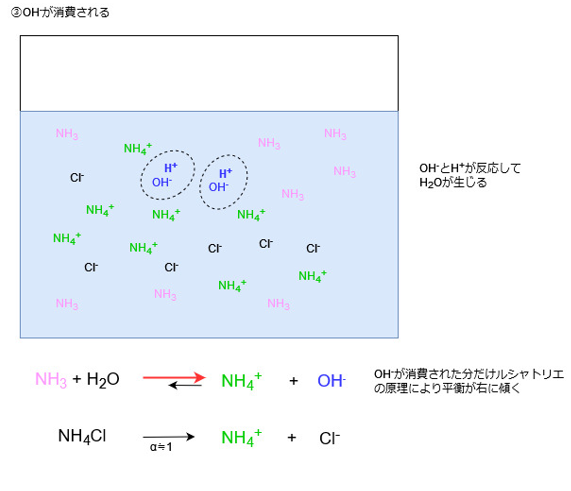
この際、水溶液中からOH–が消費されてOH–の濃度が小さくなります。
水溶液中のOH–の濃度が小さくなってpHも小さくなるかというと、そうはなりません。
ルシャトリエの原理が働き、溶液中からOH–濃度が小さくなった分だけ、それを補うようにアンモニアの電離が進むため、OH–が新たに生じます。
電離していないアンモニアは水溶液中にたくさん存在するので、H+が追加されればまた同じ反応が繰り返し起こります。
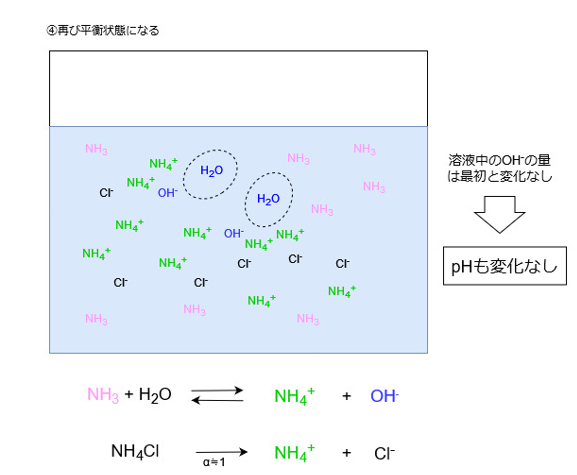
結果として溶液中のOHイオン濃度はほとんど変化しません。
25℃で水のイオン積は次のように表されます。
Kw=[H+][OH–]=1.0×10-14
したがって、OHイオンの濃度が変化しなければHイオンの濃度も変化せず、溶液のpHも変化しないということになります。
塩基を加えた場合
塩基を加えた場合、溶液中にOH–が増えます。
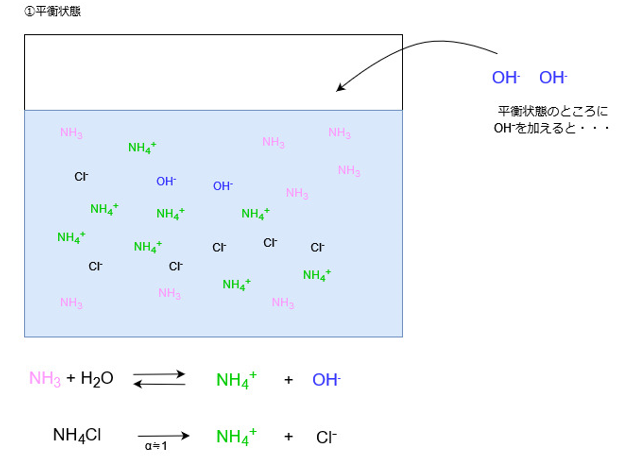
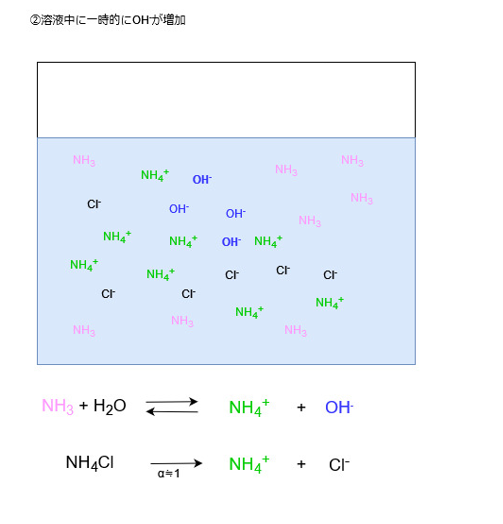
すると、増えたOHイオンはアンモニウムイオンと反応します。
これもルシャトリエの原理で、OHイオン濃度が増えた分だけ、それを減らす方向に平衡が傾くためです。
しかし、アンモニアの電離度は非常に小さいので、OHイオンのほとんどは塩化アンモニウムの電離によって生じたアンモニウムイオンと結びつきます。
塩化アンモニウムは電離度1ですので、アンモニウムイオンは溶液中に大量に存在します。
よって、比較的多くのOHイオンと結びつくことができます。
OHイオンとアンモニウムイオンが反応するとアンモニアが増えますので、今度は溶液中のアンモニアの濃度が高くなります。
すると再びルシャトリエの原理により、アンモニアを減らす方向、つまりアンモニアが電離する方向に平衡が傾きます。
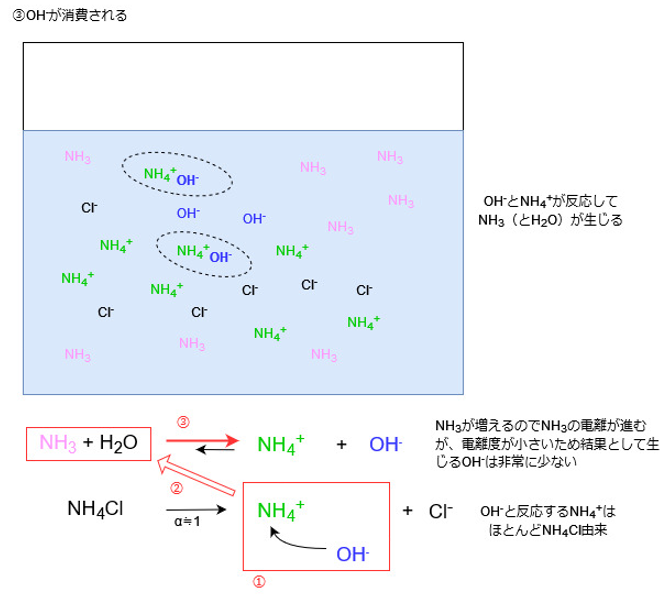
ただし、アンモニアの電離度は非常に小さいため、この結果生じるOHイオンはごくわずかです。
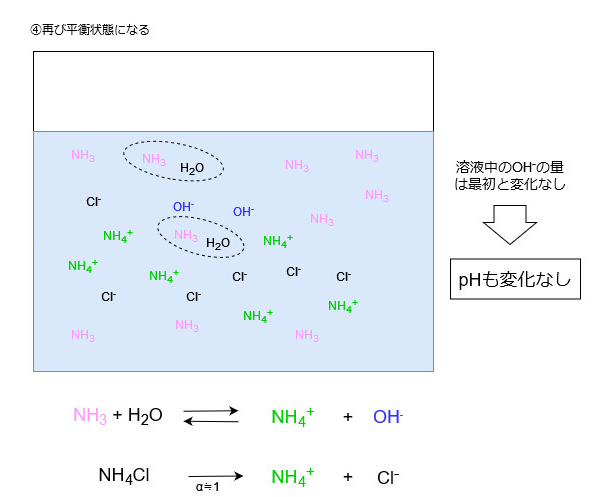
よって系全体でみると、外部から加えられた多数のOHイオンをごくわずかのOHイオンに変えたことになり、溶液中のOHイオン濃度は最初とほとんど変化しません。
OHイオン濃度が変化しないということは、pHもほとんど変化しません。
緩衝液の作用する範囲
上で見てきた内容を整理すると、以下のようにまとめられます。
・弱酸とその塩に塩基を加えた場合は弱酸の作用が大きい
(弱酸由来のHイオンが外部から加えられたOHイオンを打ち消す)
・弱酸とその塩に酸を加えた場合は塩の作用が大きい
(塩由来の共役塩基がHイオンを打ち消す)
・弱塩基とその塩に酸を加えた場合は弱塩基の作用が大きい
(弱塩基由来のOHイオンが外部から加えられたHイオンを打ち消す)
・弱塩基とその塩に塩基を加えた場合は塩の作用が大きい
(塩由来の共役酸がOHイオンを打ち消す)
このことから、緩衝液中の弱酸(または弱塩基)とその塩との濃度の関係で、緩衝液の作用に変化が出るのではないかと考えられます。
pHとpKaの関係を表したものに、ヘンダーソン-ハッセルバルヒ式というものがあり、次の式で表されます。

この式の導出方法について次で説明します。
ヘンダーソン-ハッセルバルヒ式の導出
前提として、Ka(電離定数)がどのように求められるかを見ていきます。
まず、次のような平衡状態にある可逆反応を想定し、
正反応の反応速度をν1、
逆反応の反応速度をν2、
とします。
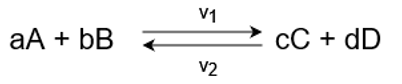
このとき、反応物の濃度によって反応速度が一般的に次のように求められます。
(多段階反応の場合はこの限りではありません)
ν1=k1[A]a[B]b
ν2=k2[C]c[D]d
k1、k2は反応速度定数といい、一定条件下(定温度・定圧力・定溶媒)であれば反応濃度が変化しても一定になる値です。
ここで平衡状態にあるため、正反応と逆反応の反応速度が等しい、
すなわち、ν1=ν2が成立しています。
よって、
k1[A]a[B]b=k2[C]c[D]d
ここで両辺をk2[A]a[B]bで割ると、次のように変形できます。
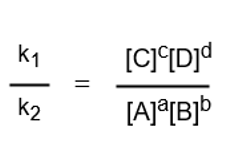
k1とk2はともに定数なので、k1をk2で割った値も定数になります。
そこで、次のように新たに定数Kを置いて次のように表すことができます。
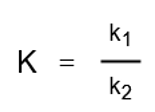
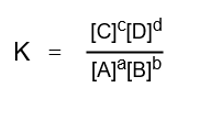
Kは平衡定数と呼ばれ、このような関係が成り立つことを質量作用の法則といいます。
名前は「質量作用」となっていますが、実際には「濃度」が作用するという点は混乱しやすいので注意が必要です。
では、ここからさらにKaを求めていきます。
具体的に酢酸の電離で考えてみましょう。
酢酸の電離は先ほど見たとおり、次の式で表されます。
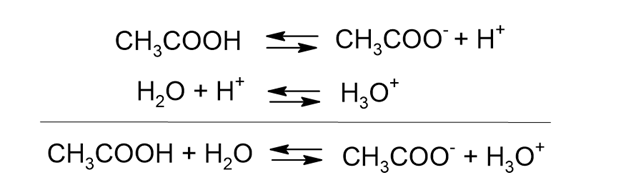
ここではヒドロニウムイオンの影響を考慮して一番下の式で考えます。
質量作用の法則より、酢酸の平衡定数Kは次のように表されます。
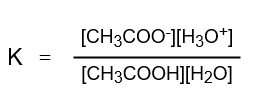
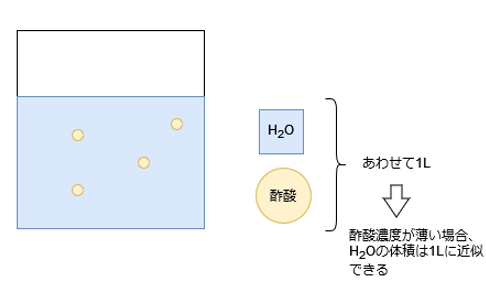
ここで、1Lの酢酸水溶液を考えます。
溶液が1Lということは、溶質である酢酸の体積と、溶媒である水の体積とが、合わせて1Lになるということです。
酢酸水溶液の濃度が薄い場合、酢酸の体積はほぼゼロと考えて、水の体積を1Lに近似できます。
H2Oの分子量は18であり、1Lの水の重さは約1000gなので、
1000gの水分子の質量数は1000÷18≒56となり、
水分子のモル濃度は56mol/Lと求められます。
溶質の濃度が薄い場合にはこの考え方が適用でき、
[H2O]=56mol/L
という一定の値をとるとみなせます。
さて、先ほどの式の両辺に[H2O]をかけると、以下の式になります。
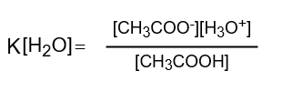
ここで[H2O]=56mol/Lで一定、Kも一定、ということでしたので、K[H2O]を新たな定数としておくことができます。
そこで、
K[H2O]=Ka
とします。
Kaのaはacid(酸)の頭文字で、Kaは電離定数と呼ばれます。
また、上でみたようにヒドロニウムイオンはつねに水分子と反応してH+を生じますので、
ヒドロニウムイオンの濃度[H3O+]は水素イオン濃度[H+]に置き換えて考えることが可能です。
したがって、Kaは次の式で表されます。
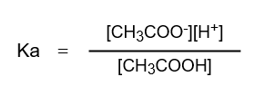
これでKaの式が求められました。
この式はヒドロニウムイオンを簡略化した酢酸の電離式
CH3COOH ⇆ CH3COO– + H+
から導かれる平衡定数Kの式と形の上では同じになります。
しかし、Kaは先ほどKa=K[H2O]とおいた通り、[H2O]=56mol/Lをかけた値です。
KaとKは同じではありません。
この点は注意が必要です。
以上は具体的に酢酸について見てきましたので、一般化しておきます。
弱酸HA(Aは共役塩基)が平衡状態にあるとき次の式が成り立ちます。
HA ⇆ H+ + A–
よってKaを一般式で表すと次のようになります。
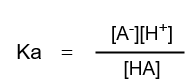
この式の両辺の対数を取ります。

ここで右辺を分解します。
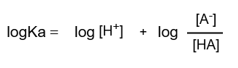
pH = -log[H+]と、
pKa = -logKa より、
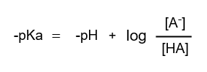
-pHと-pKaの両辺を入れ替えて、

これでようやくヘンダーソン-ハッセルバルヒ式が求められました。
緩衝液が作用する範囲
緩衝液が最も効果的に作用するのは、
pH=pKaになるとき
とされていますが、なぜそのようになるのかを考えます。
下図は25℃での酢酸の電離度とpHの関係を表したグラフです。
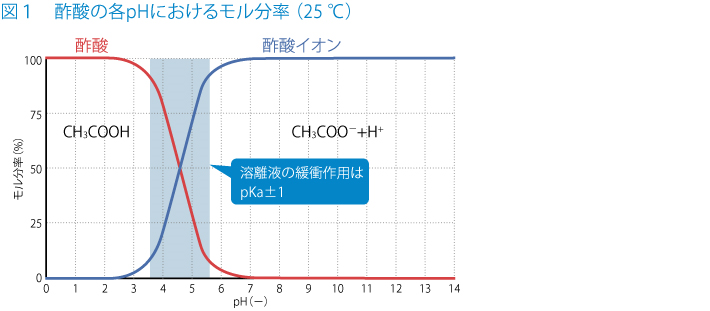
横軸のpHは環境変化を表しており、外部から塩基を加えてpHを高くすると酢酸の電離は進まなくなり、酸を加えてpHを低くすると電離が進みます。
酸を加えた場合と塩基を加えた場合のどちらにも効果的に緩衝作用を示すには、Hイオンを出す元となる酢酸のモル分率と、酢酸イオンのモル分率とが1:1になる場合がもっとも適しています。
グラフでいうと酢酸と酢酸イオンのそれぞれのモル分率を表した曲線が交差する点です。
モル分率の比とモル濃度の比は等しくなるので、
酢酸と酢酸イオンのそれぞれのモル濃度が1:1になるような場合が、最も効果的に作用する場合ということになります。
これは一般的に表すと、[HA]:[A–]=1:1、つまり、[A–]/[HA]=1のとき、ということになります。
これを先ほど導出したヘンダーソン-ハッセルバルヒ式に当てはめると、
pH=pKa+log1
となります。
ここでlog1=log100=0ですので、
pH=pKa+log1
より
pH=pKa
よって、pH=pKaのときに緩衝液が最も効果的に作用する、というわけです。
また先ほどのグラフをみると、pH=pKaの点から±1の範囲でグラフが傾いていますが、それを超えるとグラフの傾きがほとんどなくなってしまうことが分かります。
一般に、緩衝液を構成する弱酸のpKaに対して、pH = pKa ± 1の範囲が、緩衝液が効果的に作用する範囲とされています。(より厳しい基準ではpKa ± 0.5)
その範囲を超えてしまうとHAあるいはA–のどちらか一方が大部分を占めます。
pH<pKa-1の範囲では、
HAが大部分を占めるため、酸を効果的に打ち消すことができません。
逆にpH>pKa+1の範囲では、
A–が大部分を占めるため、塩基を効果的に打ち消すことができません。
また、pH=pKa±1となるそれぞれの場合の[A–]と[HA]の比率は、ヘンダーソン-ハッセルバルヒ式から以下のようになります。
pH = pKa + 1 のとき、[A–] / [HA] = 10 となります。
これは、 [A–] : [HA] = 10:1の比率です。
pH = pKa – 1 のとき、[A–] / [HA] = 0.1 となります。
これは、 [A-] : [HA] = 1:10の比率です。
緩衝液を使う場合は使用するpHの環境に合わせて、pH=pKa±1の範囲に収まるように弱酸(弱塩基)とその塩の濃度の比率を考える必要があります。
緩衝液が実際にどのように使われているかについては調べて次回まとめたいと思います。
8/3(土)学習時間:10.25H
・岡野の化学(185)~(187)
・緩衝液の原理についてまとめ
課題)
・緩衝液の用途と関連する特許の確認
その他
・0936 翻訳者募集サイトの読み方







コメントを残す