岡野の化学で稀薄溶液の蒸気圧降下・沸点上昇・凝固点降下について学習したので復習としてまとめます。
前提条件
蒸気圧降下・沸点上昇・凝固点降下それぞれの議論に入る前に、これらの議論が成り立つ前提を抑えなければなりません。
稀薄溶液の束一性
蒸気圧降下・沸点上昇・凝固点降下はいずれも「稀薄溶液の束一性」を前提としています。
稀薄溶液というのは、濃度の薄い溶液ということです。
では稀薄溶液の束一性とは何かというと、
「稀薄溶液の状態変化について、存在する溶質粒子の数だけに依存する性質」のことです。
どういう意味かというと、溶質粒子の大きさには関係なく、個数のみを考えるということです。
例として食塩水について考えてみましょう。
NaClが水に溶ける時の状態として、次のような場合が考えられます。
①Naイオン1つとClイオン1つが結合した1つのペアとして存在する場合
②NaイオンとClイオンがそれぞれ分かれて存在する場合
③NaClのペアが複数集まって一つの分子のように存在する場合
②は「解離」とよばれる状態で、分子が分解してより小さな分子、原子、イオンなどに分かれた状態です。
この場合は電荷をもったイオンに分かれているので解離の中でも特に「電離」とよばれます。
③は「会合」とよばれる状態で、同種の分子が分子間力によって2つ以上結合してひとつの分子のようにふるまう状態をいいます。
界面活性剤が作るミセルなどもこの例です。
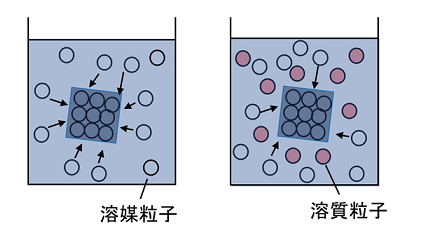
①②③を図示すると次のようになります。
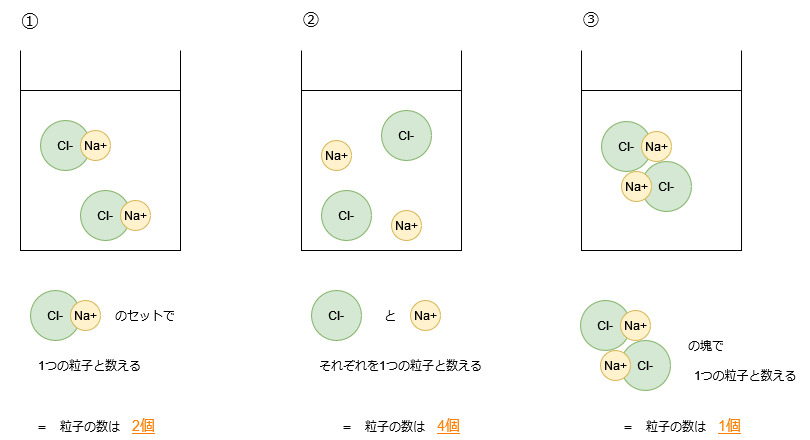
粒子の大きさは様々ですが、大きさによらず、それぞれの粒子の数によって議論するということです。
また、以下のことも前提条件になります。
・溶液中の各成分の相互作用を無視できる
・不揮発性溶液である
これらの条件を満たす稀薄溶液について、蒸気圧降下・沸点上昇・凝固点降下が議論できる、ということになります。
質量モル濃度
具体的には、蒸気圧、沸点、凝固点はいずれも溶液の質量モル濃度に比例します。
では質量モル濃度は何かというと、
溶液の濃度を「溶媒1kgに溶けている溶質のモル数」によって、単位mol/kgで表したものです。
溶液の濃度を表す他の方法としては、モル濃度があります。
モル濃度の場合は「溶媒1Lに溶けている溶質のモル濃度」によって、単位mol/Lで表したものです。
両者の違いは、以下になります。
質量モル濃度:溶媒の「質量」が基準
モル濃度:溶媒の「体積」が基準
ではなぜモル濃度ではいけないのかというと、体積は温度によって変化するからです。
一般的に、物質に熱を加えると膨張して体積は大きくなり、冷却すると縮みます。
モル濃度では溶媒の体積を基準にしているので、温度変化にともなって分母が変化してしまう恐れがあります。
したがって、蒸気圧・沸点・凝固点といった温度に関係する値を考える際は、温度によって変化しない質量を基準にした質量モル濃度を使うのが適しています。
蒸気圧降下
同じ温度で蒸気圧を比較した場合、純粋な溶媒のみの蒸気圧に対し、溶液の蒸気圧は低くなります。
この現象を蒸気圧降下といいます。
蒸気圧降下のしくみ
真空状態の容器にそれぞれ純溶媒と溶液を入れて同じ温度・時間で加熱したとします。
下図の白丸は溶媒分子、黒丸は溶質分子を表します。
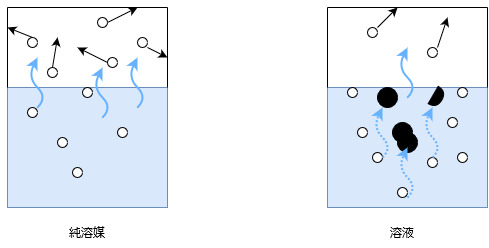
溶媒のみの場合、溶媒分子が蒸発する際にそれを妨げるものはないので、気体分子は比較的多くなります。
気体分子が多くなれば、気体分子が容器を押す力が蒸気圧ですので、蒸気圧は大きくなります。
それに対して溶液では、溶媒分子が蒸発する通り道を溶質分子が妨げます。
すると気体になれる溶媒分子は少なくなり、気体分子が容器を押す力は小さくなります。
前提条件として、溶質の大きさにはよらず溶質粒子の数のみに依存するという話をしました。
図だとわかりにくいかもしれませんが、黒丸が半円でも、丸でも、溶媒分子の蒸発を妨げるのは同じということです。
よって、溶質粒子のモル数が多くなるほど蒸気圧は下がりやすいといえます。
多くなる、と言っても前提は稀薄溶液なので、その中で比較的多い、という意味です。
また、上に書いたように、溶液中の各成分の相互作用を無視できる、という前提に立って蒸気圧と溶質モル数の関係を考えると、
「溶液中の各成分の蒸気圧はそれぞれの純溶媒の蒸気圧と混合溶液中のモル分率の積で表される」という法則が成り立ちます。
これをラウールの法則といいます。
以下のように決めると、
純溶媒:蒸気圧P゜、溶媒N+nモル
溶液:蒸気圧P、溶媒Nモル、溶質nモル
P:P゜=N:N+n より、
P=N・P゜/(N+n)が成り立つ、というものです。
ラウールの法則が成り立つ前提として溶液中の各成分の相互作用を無視すると書きましたが、現実には各成分の相互作用が蒸気圧に影響します。
例えば同じ温度なら水よりもジエチルエーテルの方が蒸気圧は高くなりやすいです。
蒸発というのは、液体分子が周囲の分子との分子間力をほどいて孤立した気体分子となって飛び出す現象ですので、溶媒同士の分子間力が弱いほど気体になりやすく、蒸気圧も高くなりやすいといえます。
水の場合はH原子とO原子の分極により水分子同士の間に水素結合が生じていますが、ジエチルエーテルの場合はそれよりも弱いファンデルワールス力で分子同士が結びついているため、より簡単に結合が切れて蒸発しやすいのです。
ラウールの法則はあくまでもこういった相互作用を無視できるものとして成り立つ法則です。
蒸気圧降下度
蒸気圧降下によってどれくらい気圧が下がるかを表したものが蒸気圧降下度で、⊿Pで表されます。
蒸気圧降下度は次の公式で求められます。
⊿P=Km(K:定数、m:質量モル濃度)
この公式は上記のラウールの法則によって次のように導かれます。
蒸気圧降下度は、P゜(純溶媒の蒸気圧)>P(溶液の蒸気圧)より、
⊿P=P゜- P
ここでラウールの法則より、
⊿P=P゜- {N・P゜/(N+n)}
∴⊿P=n・P゜/(N+n)
ここで稀薄溶液という前提があるため、溶液Nに対して溶質nは無視できるくらい小さい値となります。(n<<N)
そこでN+nをNで近似すると、
⊿P≒n・P゜/N
ここで溶媒のモル質量をMとして分母・分子をそれぞれ(M×10-3)倍します。
⊿P=n・(M×10-3) ・P゜/ N・(M×10-3)
すると、
n=溶質〔mol〕
N=溶媒〔mol〕
M=溶媒〔g/mol〕
10-3=gをkgに換算
ということになるので、
分母のN・(M×10-3)の部分は溶媒〔kg〕になります。
よって、n/ N・(M×10-3)の部分は、溶質〔mol〕/溶媒〔kg〕、
つまり、溶液の質量モル濃度〔mol/kg〕となります。これをmで表します。
そこで、残った分子の(M×10-3)・P゜を定数Kとおくと、次の公式が成り立つわけです。
⊿P=Km(K:定数、m:質量モル濃度)
さて、ある物質の分子量は、
物質量=質量÷分子量
で求められます。
つまり、溶質の物質量〔mol〕は、溶質の質量〔g〕をその溶質の分子量で割ったものとして求められるので、溶質の分子量が不明の場合に質量モル濃度が分かっていれば分子量を導き出せます。
したがって、質量モル濃度が関係する蒸気圧降下度が測定できれば、理論上は分子量を求めることが可能になります。
これは次に説明する沸点上昇、凝固点降下についても同様で、分子量測定法の一つとして使われています。
ただし先ほどから書いている通り、不揮発性の稀薄溶液で成分同士の相互作用が起きないことが前提となっている計算式のため、現実には正確に求められるとは限りません。
沸点上昇
液体が気体になるときに、液体内部からの蒸発、つまり沸騰が起こる温度が沸点です。
その沸点が、溶液の場合は純溶媒の場合よりも上昇する、というのが沸点上昇です。
沸点上昇のしくみ
蒸気圧降下のときと同じように考えられます。
溶質分子が存在すると溶媒分子の蒸発は妨げられてなかなか気体になることができないのでした。
蒸発が妨げられるということは、当然沸騰するまでにより大きなエネルギーを与えてやらないといけないということになるので、溶液は純溶媒よりも沸点が高くなると言えます。
そして基本的には溶質の質量モル濃度が高くなるほど沸点上昇の傾向が大きくなります。
沸点上昇による純溶媒の沸点との温度差を沸点上昇度といいます。
蒸気圧降下との関係
上で見たように、沸点上昇と蒸気圧降下の原理は同じです。
つまり同じ現象を別々の切り口で議論したものということができます。
この関係は次のようなグラフにするとよくわかります。
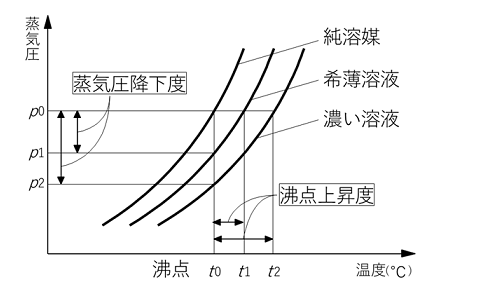
純溶媒の蒸気圧曲線を少しずつ下に平行移動すると、稀薄溶液、濃い溶液(「濃い」といっても稀薄溶液の範囲内で相対的に濃い、という意味です)の蒸気圧曲線が書けます。
同じ温度t0について見てみると、純溶媒の蒸気圧p0、稀薄溶液の蒸気圧p1、濃い溶液の蒸気圧p2は、
p0>p1>p2
の関係になっています。
純溶媒に近づくほど蒸気圧は高く、濃い溶液になるほど蒸気圧は低くなっており、蒸気圧降下が起こるということが分かります。
この曲線を、今度は同じ蒸気圧p0について見てみましょう。
すると、純溶媒の沸点t0、稀薄溶液の沸点t1、濃い溶液の沸点t2は、
t0<t1<t2
の関係になっています。
純溶媒に近づくほど沸点は低く、濃い溶液になるほど沸点は高くなっており、同じグラフから沸点上昇についても読み取れます。
注意しないといけないのは、稀薄溶液の濃度が溶液全体の質量モル濃度で表されているという点です。
前提条件のところでみたように、蒸気圧降下や沸点上昇は溶質粒子の数に依存するので、解離や会合が起きている場合はそれを考慮しないといけません。
その場合には単純に濃度によっては判断できないので、グラフの稀薄溶液と濃い溶液の場所が入れ替わる可能性があります。
凝固点降下
純溶媒に対して、溶液にすると凝固点が下がる、という現象が起こります。
これが凝固点降下です。
凝固点降下のしくみ
冷却曲線は次のように表されます。
凝固というのは、液体から固体になる状態変化のことですので、図の赤丸で囲んだ部分について考えてみましょう。
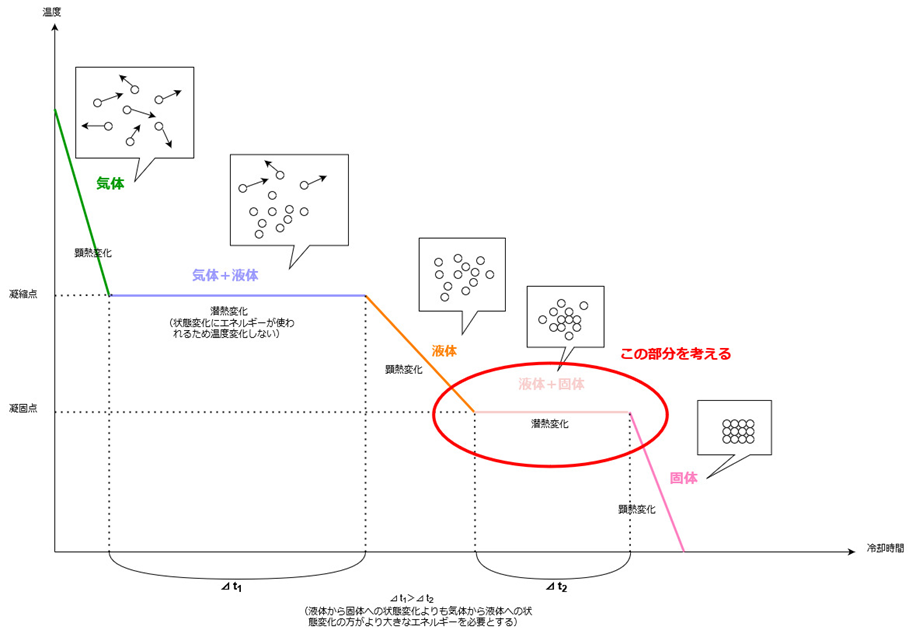
まず、純溶媒の場合を見てみましょう。
先ほどの図では簡略化して「液体+固体」の状態を一定の温度として一直線で表しましたが、実際には凝固点になるとすぐに凝固するわけではない、という点を抑えておきましょう。
最初は凝固点を過ぎても固まらない過冷却の状態になります。
そして凝固点より少し温度が下がったところで凝固が始まります。
物質が凝固する際、液体からより運動量の低い固体に変化しますので、余った運動エネルギーが熱エネルギーとして放出されます。
したがって凝固熱は発熱反応になります。
凝固が始まっているときに実は反対に固体から液体に戻ろうとする融解も同時に起きており、融解熱は逆に吸熱反応となります。
はじめは凝固のスピードが速いので融解の吸熱反応と外部からの冷却を合わせても凝固熱による発熱に追いつかず、温度が上昇します。
しかし、次第に凝固のスピードが落ち着いてくると凝固熱による温度上昇と、融解熱及び外部からの冷却による温度低下とが釣り合うようになり、温度が一定になります。このときの温度が凝固点とされます。
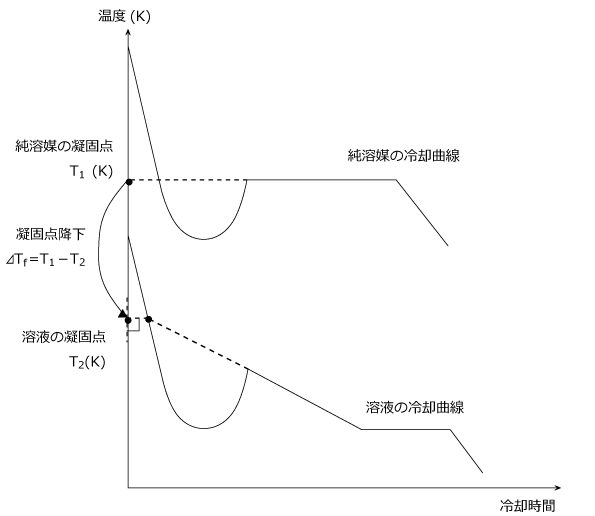
では、溶液の場合はどうでしょうか。
溶液の場合も、最初は過冷却状態になり、その後凝固を始める、という流れは純溶媒の場合と同じです。
しかし、溶液の場合はその後すぐに温度が一定になるわけではなく、右肩下がりに温度が下がっていく現象が見られます。
この時何が起きているのでしょうか。
溶液の場合は、溶媒が先に凝固を始めます。
すると、液体として残っている部分の溶媒だけで溶質を溶かすことになるため、溶液の濃度はどんどん濃くなります。
たとえばスポーツドリンクを入れたペットボトルを凍らせたものを飲んだ場合を考えてみましょう。
最初に飲んだ時はとても甘く、だんだんに味が薄くなるように感じられると思います。
これは、最初に飲み始める部分は少ない水分の中に砂糖が溶けているので砂糖の濃度が濃くなっているためです。
溶媒が凝固するには溶媒分子同士が結合する必要がありますが、溶質分子があると間に入って溶媒分子同士の結合を妨げます。
冷却時間の経過とともに溶媒の固体部分が大きくなり溶液の濃度が高くなっていくと、液体の溶媒分子はより溶質分子とぶつかりやすくなって凝固速度が遅くなります。
したがって凝固点はどんどん下がっていきます。
しかし、これ以上溶質を溶かしきれないという飽和濃度になると溶質も固体として析出し始めるため、一定の濃度で溶媒と溶質の凝固が同時に進むようになります。
ここでようやく温度が一定になります。
この時の温度が凝固点になるのかというと実はそうではなく、液体から気体に向かう温度変化のグラフと、溶媒のみが凝固していくときの右肩下がりのグラフを延長したものとが交差する点の温度が、溶液の凝固点とされます。
自動車エンジンの不凍液について
凝固点降下の現象は凍結防止剤として様々なところで利用されています。
その一例として、自動車エンジンの冷却液に添加される不凍液があります。
冬場に冷却液が凍結するのを避けるために、冷却液の凝固点を低くするという目的で、エチレングリコールやプロピレングリコールが使われています。
岡野の化学で学習し始めた最初の頃に不凍液の話は出てきました。
そのときは、物理的性質の具体例として、例えば物質によって凝固点が異なる、という文脈で出てきました。
純粋なエチレングリコールの場合、凝固点は-12.9℃です。
この温度が水の凝固点0℃より低いので不凍液となる、ということでその時は理解しました。
しかし、実際には純粋なエチレングリコールではなく、水溶液の形で使われています。
例えば60%濃度のエチレングリコール水溶液であれば、凝固点は-40℃以下になります。
そのときは水溶液にするとさらに凝固点が下がる理由が理解できていませんでしたが、凝固点降下の現象だったのですね。
これまでは成分同士の相互作用が起こらないという前提で見てきましたが、実際には溶媒と溶質の相互作用は影響します。
エチレングリコールの場合はOH基を2つ持っているので水分子と水素結合を作りやすくなります。
そのため、水分子同士が固まるのをより妨げやすく、凝固点降下の効果が高いと考えられます。
7/20(土)学習時間:11.25H
・岡野の化学(166)~(168)
・蒸気圧降下・沸点上昇・凝固点降下についてまとめ
・薬剤のpKaと吸収率の関係について
課題)
・浸透・半透膜に関係する特許明細書を調べる







コメントを残す