最近お風呂掃除をサボっていたので昨日は久しぶりに掃除をしました。
しかし、なかなか落とせないのが浴室内の窓や鏡にできた白い汚れです。

このような白い曇りのような汚れができる原因はいくつかありますが、そのひとつに「ガラスの白ヤケ」と呼ばれる現象があります。
今回はどのようにして白ヤケができるのかについて調べてみました。
ガラスの構造
まず、浴室の窓や鏡に使われるガラスがどのような構造をしているのか確認しましょう。
ガラスの基本単位となるSiO2はsp3混成軌道によって正四面体構造をとります。
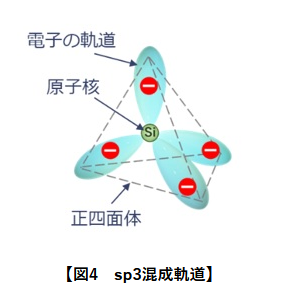
SiO2のひとつの分子に注目すると、O原子と結合する手が2本、未結合手が2本、出ている状態になります。
この未結合手が周囲にある他のSiO2分子のOと結合して下図のように網目構造を作ります。
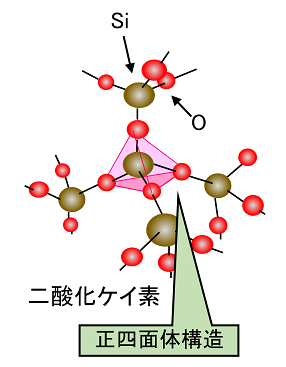
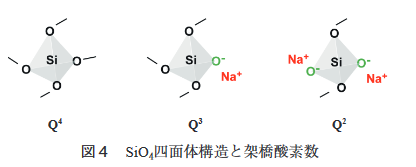
この際、2つのSiO2分子をつなぐ役割をしているO原子を架橋酸素といい、他のSiO2分子のSi原子とは結合していないO原子を非架橋酸素といいます。
非架橋酸素はSi原子の代わりにNaイオンなどのアルカリ金属イオンとイオン結合しています。
ガラスと水の反応
ガラスの基本構造となるSiO2は水に溶けませんが、非架橋酸素と結合しているNaイオンなどは比較的容易に水に溶け出します。
これはガラス構造の限られた非架橋酸素と結びついているよりも、水中で水分子に囲まれて水和イオンを作っている方がNaイオンが比較的安定して存在できるためだと推測します。
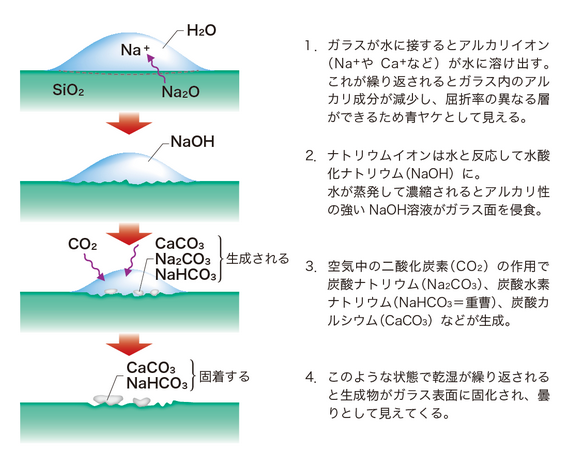
よって、ガラスに水が付着するとガラス表面では以下のような反応が進行します。
(Naイオン以外にもCaイオンなども存在しますが、Naイオンで代表して説明します)
(1)ガラス中のNaイオンなどが水滴の中に溶け出す
(2)Naイオンが水中に溶けだす代わりに水中のヒドロニウムイオンがガラス内に入ってくる(イオン交換)
(3)元々Naイオンと結合していて余ったO原子にHイオンが結合し、Si-OHの構造ができる(ガラスの加水分解)
(4)ガラスから溶けだしたNaイオンとヒドロニウムイオンからHイオンが取れてできたOHイオンが結合してNaOHが生じる
(5)強塩基性のNaOH水溶液ができる
ガラス面からNaイオンが単独で水中に出ていくだけでは塩基性の水溶液にはなりません。
NaOHが電離してOHイオンが生じていることがポイントです。
(5)水が蒸発していくとNaOH水溶液が濃縮されて強いアルカリ性を生じる
一般的に弱酸・弱塩基の水溶液の場合、濃度が濃くなると酸性度・塩基性度は小さくなります。
これは一定量の水の中にイオンが電離できる量が限られていて、水分が少なくなるとその分電離できる量が減るためです。
しかしNaOH水溶液のような強塩基は元々電離度1(ほぼ100%電離する)であるため、濃度によって電離度が小さくなるという影響はほとんど受けません。
(6)NaOH水溶液がガラス面を侵食する
O原子は電気陰性度が強いためガラスのSi-O間には分極が生じています(Siがδ+、Oがδ–)。
OHイオンは負の電荷をもつため、正の電荷に引き付けられるという求核性をもちます。
そのため、ややプラスに電荷が偏っているSi原子を攻撃してSi-Oのネットワークを切断し、Si-OHを形成します。
(7)空気中のCO2がNaOH水溶液と作用し、NaHCO3(重曹の成分)などが生成される
Caイオンの場合はCaCO3(貝殻やチョークの成分)が生成されます。
(8)乾湿が繰り返されると侵食されたガラス表面にNaHCO3などが固化し、白ヤケとなる
白ヤケを除去するには
白ヤケを取り除いて窓や鏡をきれいな状態に戻すにはどうすればよいでしょうか。
白ヤケの原因がNaHCO3やCaCO3だと分かったので、これらを溶かす方法を考えればよさそうです。
NaHCO3はNaOH(強塩基)とH2CO3(炭酸)の塩と考えられるので、強酸(炭酸より強い酸)によって弱酸の遊離を起こさせて溶かすことができます。
CaCO3の場合はCa(OH)2(強塩基)とH2CO3(炭酸)の塩と考えられるので、こちらも同様に強酸によって溶かすことができます。
家庭で簡単に使えるものとしてはクエン酸があります。
クエン酸と炭酸のpKaを比較してみましょう。
その前にpKaとは何かについて確認しましょう。
pKaとは
pHは水溶液中のHイオン濃度の負の常用対数(pH=-log[H+]、[ ]は成分の濃度を表す)で定義されましたが、
pKaは解離のしやすさを表した酸解離定数(Ka)の負の常用対数(pKa=-logKa)で定義されます。
酸をHAとすると(A- は共役塩基)、酸解離定数(Ka)は次のように表されます。
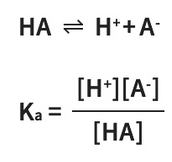
pKaが小さいほど、酸性度が強いということになります。
pHとの関係で考えると分かりやすいです。
pH=pKaとなるときというのは、酸の50%が電離してイオンになっているときということです。
pH>pKaのときは、電離している割合が半分より多いということを表します。
pH<pKaのときは、電離している割合が半分より少ないということを表します。
例えば酢酸のpKaは4.8ですが、これはpH=4.8となる酢酸水溶液中では50%が電離している、という意味です。
なぜpHではなくpKaを使うかというと、
pHはその水溶液の濃度での固有の酸性度を示すのに対し、
pKaは同じ物質の水溶液であれば溶液の濃度に依存せず一定の酸性度を示すことができるため、
異なる種類の水溶液の酸性度を比較するにはpKaを使うのが適しているのです。
さて、pKaで比較してみると、次のようになります。(Wikipediaより)
クエン酸:pKa=2.87
炭酸:pKa=3.60(1段階目), pKa=10.25(2段階目)
炭酸のpKaが2種類書いてあるのは、炭酸の電離が次の2段階で進むためです。
H2CO3 ⇆ HCO3– + H+ (1段階目)
HCO3– ⇆ CO32- + H+ (2段階目)
いずれにしても、クエン酸の方が炭酸よりもpKaが小さく、酸性度が高いと言えます。
よってクエン酸を用いて白ヤケを除去するという方法は有効だと考えられます。
ただし、クエン酸を使った後にきちんとすすがないとガラスの表面に酸が付着したままになり、今度はこれが原因でガラス表面が侵食される恐れが出てくるので注意が必要です。
ガラスのヤケについては青ヤケという現象もあるようなので、光の屈折や干渉について基礎を学習した後で原理を確認したいと思います。
参考)
・山下勝「ガラスの耐水性」ニューガラス. Vol.26, No.3, 2011
・AGC株式会社”ガラスの組成と風化”ガラスプラザ https://www.asahiglassplaza.net/knowledge/rg_knowledge/vol25/(参照2024-07-20)
7/19(金) 学習時間:5.75H
・岡野の化学(165)
・白ヤケについて
その他
・3123 世界標準の勉強法







コメントを残す