なんとか無事に初仕事の納品が終わったので、またグルコースセンサに関する学習に戻ります。
グルコースセンサに関する前回の記事では、糖尿病治療において血糖値(グルコース値)のモニタリングが重要であるということ、非侵襲型のグルコースセンサへの需要があり研究が進んでいるということを書きました。
しかし、現在はまだ低侵襲型のグルコースセンサが主流となっています。
今回は、低侵襲型のグルコースセンサにおけるグルコース値の測定方法として主流になっている電流測定法(アンペロメトリック方式)を取り上げます。
電流測定法とは、簡単に言うと、グルコースの酵素反応を利用して生じる電流を測定し、その測定値からグルコース濃度を算出する、というものです。
以下で、その原理について、日本企業の特許を紹介しつつ説明していきます。
目次
酸化還元型酵素
まずはグルコースの酵素反応について見ていきましょう。
酵素は、生体内で化学反応を促進する触媒として働きます。
その触媒する化学反応の種類によって分類され、例えば次のようなクラスがあります。
- 酸化還元酵素(oxidoreductases):物質の酸化還元反応を触媒する酵素(例:オキシダーゼ、デヒドロゲナーゼ)
- 加水分解酵素(hydrolases):加水分解反応を触媒する酵素(例:アミラーゼ、リパーゼ)
- 転移酵素(transferases):官能基の移動を促す(例:キナーゼ)
このうち、グルコースセンサに関係するのは「酸化還元酵素」のグループです。
特にグルコースに作用する代表的なものが、グルコースオキシダーゼとグルコースデヒドロゲナーゼです。
グルコースオキシダーゼ(GOx)
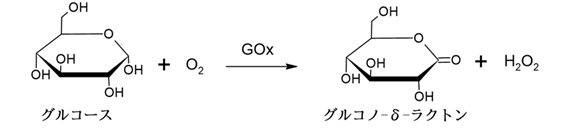
グルコースオキシダーゼ(GOx)は、酸素を電子受容体として用いて、グルコースの酸化反応を触媒する酵素です。
具体的には下の式のように、グルコースと酸素が反応し、グルコノラクトンという物質と過酸化水素が生成されます。
• グルコースデヒドロゲナーゼ(GDH)
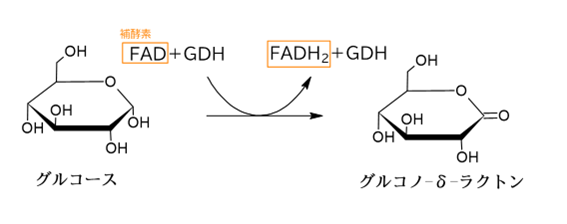
グルコースデヒドロゲナーゼ(GDH)は、グルコースから水素原子を引き抜くことにより、グルコースの酸化を触媒する酵素です。
また、オキシダーゼと違い、触媒反応において補酵素(例:FAD、PQQなど)を必要とします。
補酵素とは、酵素と結合している非タンパク質(多くはビタミンからなる)のことで、酵素の活性に関与する重要な部分です。
酵素:グルコースデヒドロゲナーゼと、補酵素:FAD(フラビンアデニンジヌクレオチド)の場合でいうと、デヒドロゲナーゼの「水素原子を引き抜く反応を触媒する」という作用において、FADは引き抜かれる水素原子の受け取り手として機能します。
この補酵素がないと酵素の触媒作用は生じません。
具体的には、下のような反応が行われます。
電流測定法の原理
上で見てきたグルコースの酸化反応では、酵素の作用によりグルコースが酸化されることで電子が放出されます。
このときの電子の受け渡しにより電子の流れが生じますが、この電子の流れが電流の正体です。
このように、酸化還元をはじめとする物質間の電子の授受とそれに伴う現象を扱う分野を電気化学といいます。
グルコースの酵素反応によって生じる電流の変化を測定することによりグルコースの反応量を導き出し、グルコース濃度を算出する、という、電気化学的な測定方法が電流測定法によるグルコースセンサです。
目に見えない酵素反応を「電流」という形で数値化するという点が、電流測定法を用いたグルコースセンサのポイントです。
以下で、電流測定法で一般に使用される装置の構成について見ていきましょう。
三電極系
電気化学と聞いて、まず電池を思い浮かべる方も多いかと思います。
電池では通常、正極と負極という2つの電極で電位差を生み出して電流を生じます。
一方、電流測定法などの電気化学測定では通常、作用電極・参照電極・対電極の3つの電極を用いる三電極系の構成が一般的です。
2つの電極のみを用いた場合には、電流に応じて対電極の電位も変動するため、2つの電極の電位差しか制御できず、作用電極の電位を安定して保つことができません。
そこで、電子のやりとりが行われる作用電極と対電極の他に、もう一つ参照電極を追加します。
この参照電極自体には電流は流れないため、参照電極の電位は変化しません。そこで、参照電極に対する作用電極の電位を測定することで、作用電極の電位を正確に測定・制御できるようになります。
ポテンショスタット
電気化学測定には大きくわけて、次の2通りの方法があります。
- 電流を制御しながら電圧変化を測定する方法
- 電圧を制御しながら電流変化を測定する方法
前者において電流制御に用いられる装置をガルバノスタットといい、
後者において電圧制御に用いられる装置をポテンショスタットといいます。
両者を組み合わせて使用することもありますが、今回取り上げた電流測定法は電圧を一定にしてグルコースの酵素反応に伴う電流変化を測定するものなので、通常はポテンショスタットが使用されます。
先ほど見た三電極系において参照電極に対する作用電極の電位を一定に保つように制御することにより、電流変化を測定することができるようにするのがポテンショスタットの役割です。
ポテンショスタットのオペアンプ制御
実験などで使用されるポテンショスタットは下の写真のような結構大きなもので、さすがにこれを自己測定タイプのグルコースセンサに組み込むことはできません。
しかし、ポテンショスタットの基本的な働きを担っているのは演算増幅器(オペアンプ)と呼ばれる小さな電子回路部品であるため、これであればグルコースセンサに組み込むことができます。


オペアンプは、回路記号では、下図のように横向きの三角形の記号で表されます。
三角形の底辺部分に2つの入力端子(+-)がつながれ、三角形の底辺に向かい合う頂点が出力端子になっています。
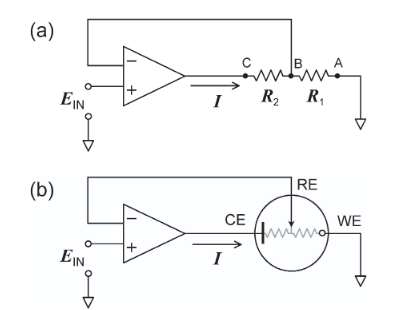
詳しい原理は割愛しますが、オペアンプでは2つの入力端子の電位差が0になるように出力をするという制御が行われています。
上図の(a)を参照すると、B点での電圧はEIN と等しくなるように制御されることになり、さらにA点は基準電位0Vに接続されているため、AB間の電位は常にEINに等しくなります。
この図(a)の各点A、B、Cをそれぞれ作用電極(WE)、参照電極(RE)、対電極(CE)、に対応させたのが図(b)です。
参照電極と作用電極との電位差がAB間の電位差にあたる、すなわち参照電極と作用電極の電位差は一定に保たれる、ということになるので、この状態で流れる電流変化を測定すれば、電圧を制御した状態で化学反応による電流変化を測定することができます。
電流測定法によるセンサ技術の世代
上記のような電流測定法によるグルコースセンサは、主に使用する酵素と電子の授受の方法により、大きく以下の3つの世代に分類されます。
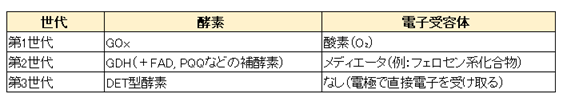
第1世代
第1世代は、先に紹介したグルコースオキシダーゼ(GOx)を主な酵素として用いたセンサです。
GOxを用いて、作用電極表面でのグルコースの酵素反応で生じる電子の授受に伴う電流を測定します。
第1世代は1950年代に発明され広く使われた方法ですが、酸素が不足すると全てのグルコースが反応できないため、測定値が酸素濃度に依存してしまうという問題点がありました。
また、副生成物の過酸化水素を電極酸化して測定するという方法も考案されましたが、これには高電圧が必要とされ、その結果、生体内の他の物質も酸化されてしまい、正確な読み取りができなくなったり、酵素活性を低下させたり、といった問題がありました。
第2世代
第1世代の問題を解決するため、1980年代に発明されたのが、グルコースデヒドロゲナーゼ(GDH)を主な酵素として使用する第2世代型のセンサです。
第2世代に特徴的なのは、メディエータと呼ばれる電子伝達物質を用いている点です。
このメディエータと呼ばれる物質は、酵素反応によって生じた電子を受けとり、それを電極で放出する、という電子の受け渡しの仲介役を果たします。
第2世代では、酸素の代わりにメディエータを使うことで、酸素に依存することなく、また過酸化水素も生成しないため、第1世代の問題を解決することができました。今回取り上げる特許は、この第2世代型に基づいた構成になっています。
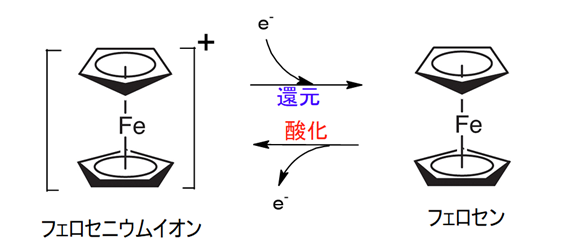
主なメディエータとしては、フェロセン系化合物やキノン系化合物などが挙げられます。
フェロセンは、上下の五角形の炭化水素環に鉄イオンが挟まれたような構造をしています。
フェロセンは酸化還元の可逆的な反応が可能であるため、電子の運び手として機能することができます。
つまり、酵素から電子を受け取り(自身は還元され)、その後、電極で電子を放出する(自身は酸化される)というメディエータの役割を担えるのです。
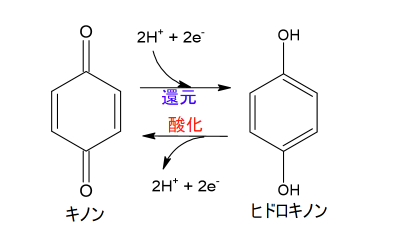
キノンは、ベンゼン環の水素原子2つを酸素で置換した構造であり、こちらも同様に酸化還元の可逆的な反応が可能であるため、メディエータとしての役割を果たします。
第2世代のデメリットとしては、メディエータは使用環境(高温や長期間使用など)によっては毒性が懸念されるものがあることや、装置設計がやや複雑になるといった点が挙げられます。
第3世代
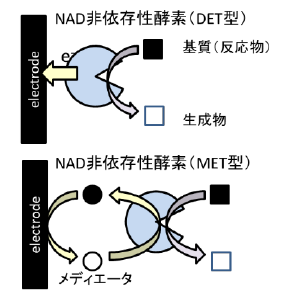
第3世代の特徴は、メディエータを用いずに直接電子移動(direct electron transfer;DET)型酵素を使用するという点です。
第1世代では酸素が、第2世代ではメディエータが、それぞれグルコースが酸化される際に放出される電子を受け取って電極で放出するという電子受容体の役割を担っていました。
これに対してDET型酵素の場合は、酵素自体に還元反応を行う部位と酸化反応を行う部位の両方が備わっているのです。
DET型酵素の例としては、FAD-GDHにヘムドメインが結合したものがあります。
FADによるグルコースの酸化自体は第2世代と同様ですが、メディエータを介さず、酵素の一部であるヘムドメインという部位が電子を電極で直接放出することができます。
第3世代の方法は、第1世代で問題となった酸素依存性や高電圧の問題もなく、第2世代のメディエータの毒性に関する懸念も回避できる点で優れています。
その一方で、使用できる酵素が限られるという点が課題となっています。DET型酵素は酸化還元酵素の0.01%ほどしか存在しないと言われています。
酵素の固定化
酵素を用いる電流測定法では、酵素を長期間安定して利用できるようにするために、酵素を電極に固定化することが重要となります。
酵素の固定化には一般的に以下のような方法があります。
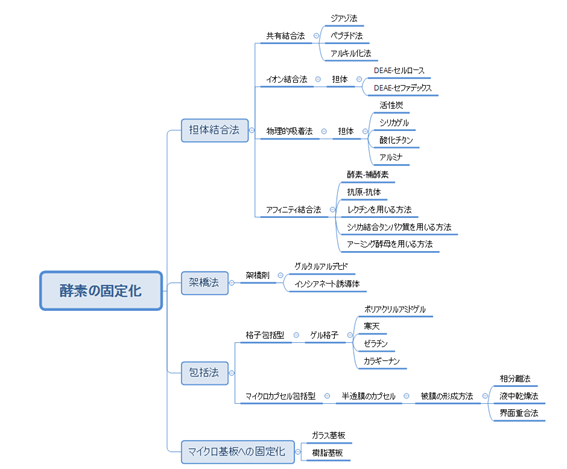
この中で電極への固定化として代表的なものを取り上げて説明します。
担体結合法
担体結合法は、化学的結合または物理的結合によって、不溶性の担体に酵素を固定させる方法です。
酵素はタンパク質でできており、タンパク質を構成するアミノ酸に含まれるカルボキシ基(-COOH)、アミノ基(-NH2)をはじめ様々な官能基が含まれています。
- 共有結合法:酵素に含まれるこれらの官能基と担体を共有結合させる方法。
- イオン結合法:酵素表面に露出しているアミノ酸残基に由来する正または負の電荷を利用して担体とイオン結合させる方法。
- アフィニティ結合法:酵素-補酵素の相互作用など生体分子間の特殊な相互作用を利用して担体と結合させる方法。
- 物理的吸着法:活性炭やメソポーラスシリカといった多孔質材料などを利用して、ファンデルワールス力で担体表面に酵素を固定させる方法。
といった方法があります。
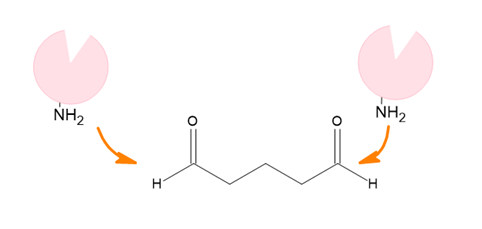
架橋法
一分子内に2つ以上の官能基をもつグルタルアルデヒドなどの架橋剤を用いて、架橋剤となる化合物の各官能基と酵素中の官能基を結合させることで、酵素同士を架橋させるという方法です。
電流測定法に関連する特許:特許7641891
第2世代型の電流測定法を利用した特許として、特許7641891を紹介します。
発明の課題
この発明の背景として問題となっていたのは、酵素の基質特異性です。
通常、基質(酵素が反応する相手、ここではグルコース)と酵素は鍵と鍵穴の関係になっており、特定の基質に対してしか酵素は働きません。これを基質特異性といいます。
このような特性があるために、酵素反応により生じる電流変化はグルコース濃度に比例して、グルコース値が算出できるとされています。
しかし、酵素がグルコースと似た構造を持つ他の化合物にも反応してしまうということになると、センサの信頼性は大きく損なわれます。
例えば、グルコースと似た構造をもつ他の糖として、グルコースが2分子つながった構造をしているマルトースがあります。
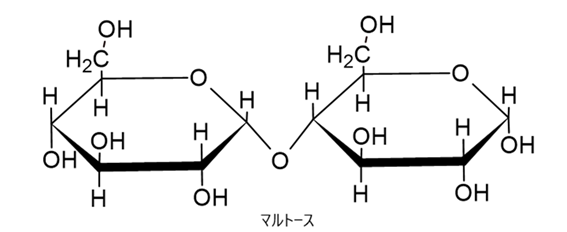
酵素がグルコースだけではなくマルトースなど他の糖とも反応するとなると、この反応をもとにした電流測定値は誤測定となってしまいます。
誤った測定結果をもとに算出されたグルコース値を用いれば、必要以上に血糖値を下げて患者に悪影響を及ぼすといった重要な問題になりかねません。
課題の解決方法
こうした問題を解決するために、先行技術では、酵素そのものを改変してマルトースなどの他の糖と反応しないような酵素を作り出すことが研究されてきました。
一方、この特許では、酵素自体を改変することなく、代わりに「基質特異性改変剤」というものを用いています。
基質特異性改変剤とは、グルコースと構造は似ているものの、それ自体は酵素(FAD-GDH)とは反応しない化合物とされています。これを加えることにより、酵素がマルトースと反応することを抑制できるというのです。
評価方法-比色法による測定
基質特異性改変剤を加えることにより酵素がマルトースと反応することを抑制できる、というのがこの特許の趣旨です。
なぜ基質特異性改変剤を加えるとマルトースとの反応が抑制されるのか、については明細書内で示されていませんが、特許においてはそのメカニズムが不明であっても、実験結果で効果をきちん実証できていれば、発明として認められます。
参考(https://www.interbrain-ip.com/column/51)
この特許では、効果の実証方法の一つとして比色法という方法を用いています。
比色法とは、発色試薬などを用いて対象物質を発色させ、その色の変化から濃度などを特定するという方法です。
この特許では、GDHを基質(グルコースまたはマルトース)と反応させ、その電子を媒介するメディエータにより還元する発色試薬の色の変化を測定しています。
この特許での測定方法の流れは以下の通りです。
比色法の吸光度測定には以下の2種類があり、この特許ではどちらで測定することも可能です。
- レート法:酵素反応が一定速度で行われている際の単位時間当たり(例えば1分間あたりなど)の吸光度変化速度を測定する方法。
- エンドポイント法:反応が全て終了した時点(サンプル中のグルコースが全て反応した時点)までの吸光度変化量を測定する方法。
上の手順はグルコースの濃度測定に関するものですが、これをマルトースの場合も同様に行うことで、マルトースへの反応性も定量できます。
産業上の利用可能性
この特許では、グルコースセンサの信頼性向上だけでなく、バイオ燃料電池としての用途も想定されています。
バイオ燃料電池は、酵素や微生物細胞を触媒にして、有機物を燃料に用いて発電する、環境にやさしい電池として近年注目されています。
これまで見てきたような酵素反応で生じる電流を取り出して利用することで、電池としての利用が可能になります。
電池として利用する際、様々な糖と酵素との間で反応が起きてしまうと電力の出力が不安定になってしまいますが、基質特異性改変剤を用いて反応の選択性を高めることで、安定した出力が可能になります。
こうした酵素反応の電池としての側面を利用することで、外部電源の不要な自立型グルコースセンサの開発も近年進んでいます。
この特許内に自立型センサという具体的な記述はありませんが、バイオ燃料電池としての可能性を示すことで、このような応用も示唆されていると思われます。
[参考]
・「マクマリー生物有機化学 生化学編」丸善出版
・有吉欽吾「電気化学関係で主に用いられる測定機器:ポテンショスタットの動作原理」(電気化学、第80巻、第8号、2012年)
・戸田弘「固定化酵素・細胞の利用」(生物工学、第96巻、第8号、2018年)
・足立大宜、宋和慶盛「第三世代型バイオセンサの開発研究」(分析化学総説、第72巻、2023年)
・特許第7641891号明細書








① グルコースが酵素FAD-GDHと反応して酸化される。
② ①の反応で生じた電子をメディエータ(フェナジンメトサルフェート;PMS)が受け取り、還元される。
③ PMSは受け取った電子を、発色試薬(2,6-ジクロロインドフェノール;DCIP)に渡し、DCIPが還元される。
④ DCIPは還元されるに伴い、青色から無色へと変化していく。
⑤ DCIPの色変化を分光光度計で測定し、消失度合をDCIPの特異的な吸収波長である600nmにおける吸光度の変化量として検知する。
⑥ あらかじめ標準濃度のグルコース溶液を用いて作成していたグラフ(キャリブレーションカーブ)を元に、サンプル中のグルコース濃度を算出する。