昨日の記事で、遷移元素のイオン化エネルギーが横並びになっている理由について調べる中で遷移元素の性質に4s軌道と3d軌道の複雑な関係が影響しているようだということを書きました。
ただ、昨日の記事にまとめたところでは、CrとCuでは4sの電子が1個入ったら次は3dの電子が先に埋まっていくという不思議な電子の入り方をしていることを見落としていました。
前の元素で4sが埋まっていたからCrとCuの場合もそうなっていると思い込んでしまっていたようです。
先入観を持たずに1個ずつ自分で書いてみないといけませんでした。
さて、前回の記事では全然理解できていませんでしたが、
遷移元素の第一イオン化エネルギーがほぼ横並びになる理由と、
4s軌道と3d軌道に複雑な入り方をする理由について、
「1160 岡野の化学特別授業」を見てようやく少し整理できました。
遷移元素の第一イオン化エネルギーについて考えるとき、電子1個は一番外側の4s軌道から取り去られます。
電子が入っていくときを考える場合、4s軌道と3d軌道では4s軌道の方がエネルギーが低いということでしたが、原子核との距離を考えると4s軌道の方が外側にあります。
4s軌道と陽子の間には3d軌道が入っているので、3d軌道の電子が陽子の引力を受け止め、4s軌道の電子対する陽子の支配力が小さくなります(遮蔽効果)。
遷移元素の場合は3d軌道の電子の数は変わりますが一番外側の4s軌道の電子の数はほぼ変わらないため、イオン化エネルギーにそれほど差が出ないと考えられます。
この遮蔽効果はNMR分光法の仕組みにおいて重要な考え方のようなので、遮蔽効果とNMR分光法の関係については知子の情報に今後の課題として入れておきます。
またCrとCuで3d軌道が4s軌道より先に埋まるのは、遮蔽効果による安定化だったり、3d軌道の電子同士の反発を減らすことによる安定化を総合して、より安定する配置を選択するということでした。
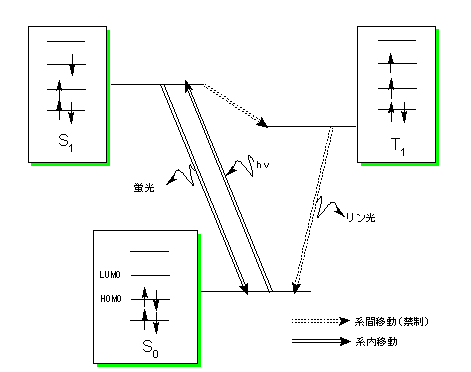
蛍光と燐光で励起状態の電子のスピンの向きが逆になるということを先日学習しましたが、これも電子同士の反発が少なくなるような配置をとるということのようです。
CrとCuは通常4s軌道に入るはずの電子1個が3d軌道に入ることで3d軌道がそれぞれ半閉殻と閉殻の状態になります。
CrとCuに関しては4s軌道が先に埋まるよりもこの方が安定するということですね。
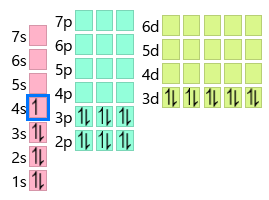
またCuがイオン化する場合を考えるときも、
Cu+の場合は4s軌道から1個電子が取れて3d軌道が閉殻になるのに、なぜ4sと3dから1個ずつ電子が取れたCu2+の方が安定的なのかという話になりますが、これも上記のような色々な要因を総合するとCu2+の方がより安定な状態になるということなんですね。
電子の存在する確率をわかりやすく軌道という形にして議論しているので実際の現象をすべて理論的に説明できるわけではないということで、あまり追究せずにそういうものなんだなと思っておきます。
5/24(金)学習時間:6.5H
・岡野の化学(89)~(99)
・1160 岡野の化学特別授業(銅イオン)
・遷移元素の電子配置についてまとめ
課題)
・1160のビデオで学習した内容について、錯体と色の関係がまだノート整理できていないのでその続きから取り掛かる
その他
・2748 睡眠の質を上げる
・4299 時間を無駄にしてはいかん








コメントを残す