先日は腸溶性錠剤に関する特許を読んだので、今度は腸溶性カプセル剤に関する特許を読んでみました。
請求項は下記の通りです。
【請求項1】
無水グルコース単位当たりのアセチル基モル置換度が0.6~0.8であり、前記アセチル基モル置換度と無水グルコース単位当たりのスクシニル基モル置換度との比(アセチル基モル置換度/スクシニル基モル置換度)が2.0~4.0であるヒプロメロース酢酸エステルコハク酸エステルと、中和剤と、水とを少なくとも含み、水溶性ゲル化剤を含まない、浸漬法により製造される腸溶性硬カプセル用組成物。
【請求項2】
前記スクシニル基モル置換度と当量のアンモニアにより中和された前記ヒプロメロース酢酸エステルコハク酸エステルの15質量%水溶液が、5~60℃のゲル化温度を有する請求項1に記載の腸溶性硬カプセル用組成物。
【請求項3】
前記スクシニル基モル置換度と当量のアンモニアにより中和された前記ヒプロメロース酢酸エステルコハク酸エステルの15質量%水溶液が、60℃において、10Pa以上のゲル強度を有する請求項1又は請求項2に記載の腸溶性硬カプセル用組成物。
【請求項4】
前記ヒプロメロース酢酸エステルコハク酸エステルのスクシニル基のモル数を100モル%とした場合、前記中和剤が、80~120モル%含まれる請求項1~3のいずれか一項に記載の腸溶性硬カプセル用組成物。
【請求項5】
50~80℃に加熱した成形ピンを、請求項1~4のいずれか一項に記載のヒプロメロース酢酸エステルコハク酸エステル含有腸溶性硬カプセル用組成物に浸漬する工程と、
浸漬された成形ピンを前記腸溶性硬カプセル用組成物から引き上げる工程と、
引き上げられた成形ピン上に形成された、前記ヒプロメロース酢酸エステルコハク酸エステルのゲル層を乾燥する工程と
を少なくとも含む腸溶性硬カプセルの製造方法。
軟カプセルと硬カプセル
薬剤には下図のように様々なタイプがありますが、カプセル剤は錠剤に次いで広く用いられています。
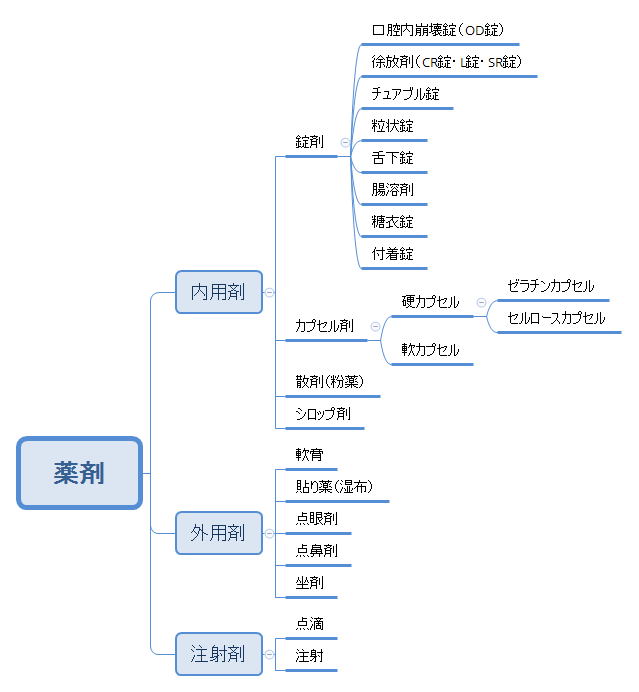
カプセル剤は硬カプセルと軟カプセルの2種類に分けられます。

軟カプセル:
液状またはペースト状の有効成分を、ゼラチン等の基剤にグリセリンやソルビトールなどの可塑剤を加えて作られる皮膜で包んだタイプです。
高い密封性があり、内容物の味やにおいを抑えやすいという効果があります。
硬カプセル:
カプセル剤と聞いて多くの人がイメージするのはこちらのタイプかもしれません。
ガチャガチャのカプセルのようにボディとキャップに分かれるカプセルの中に、粉末や顆粒状の有効成分を充填したタイプです。
硬カプセルの製法
カプセル剤の製法は大きく二段階に分かれます。
容器となるカプセルを製造する段階と、その中に有効成分を充填する段階です。
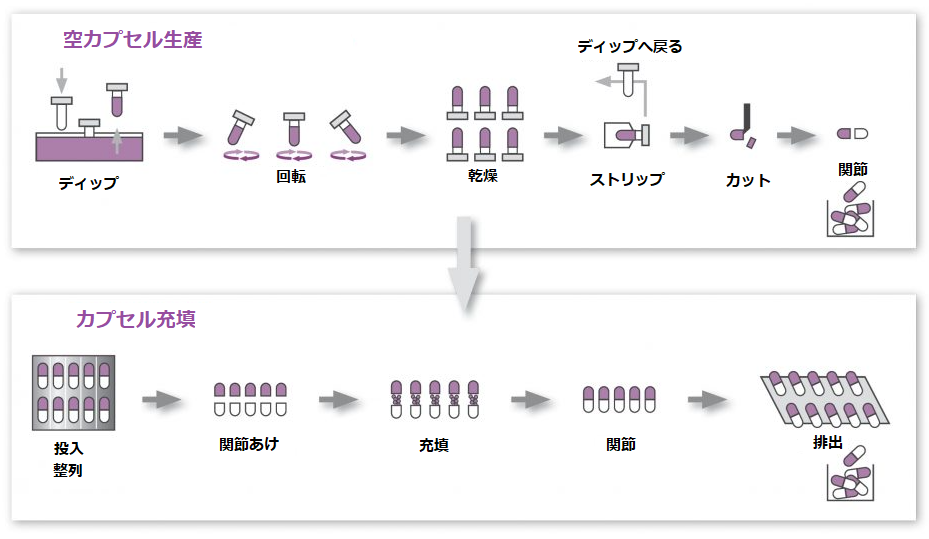
今回の特許で対象となるのは、前半部分のカプセルを製造する過程です。
形成ピンとよばれるカプセルの型となるものをカプセル原料の溶液に浸漬させ、それを引き上げて乾燥させると、ゲル状のカプセルのボディ部分とキャップ部分がそれぞれ出来上がります。
このような方法はディッピング法と呼ばれます。
セルロース系カプセルの登場
ゼラチンは加工性に優れており、カプセルの原料として広く使われていましたが、
しかし、狂牛病の流行が原因で豚や牛などの骨や皮から作られるゼラチンは安全面で懸念され、ゼラチンに代わるカプセル材料の研究が進みました。
その中で注目されたのが、植物から得られるセルロースの誘導体を基材とするカプセルです。
しかしゼラチンカプセルが普及していたため、カプセルの製造はゼラチンの低温ゲル化特性に適したディッピング法に依存していました。
セルロース自体はOH基を多く持ちますが、そのままでは水に溶けません。
OH基は分子内・分子間の水素結合に使われ、溶媒の水とは水素結合を作りにくくなるためです。
ヒプロメロース(HPMC)
そこでディッピング法に適した水溶液を作るために、OH基のHの一部をメチル基(-CH3)やヒドロキシプロピル基(-CH2CH(CH)3OH)に変えてエーテル化することにより、
分子内・分子間の水素結合を抑えて、溶媒の水分子との間に水素結合を生じさせ、水に可溶にしたものがヒプロメロース(HPMC)です。
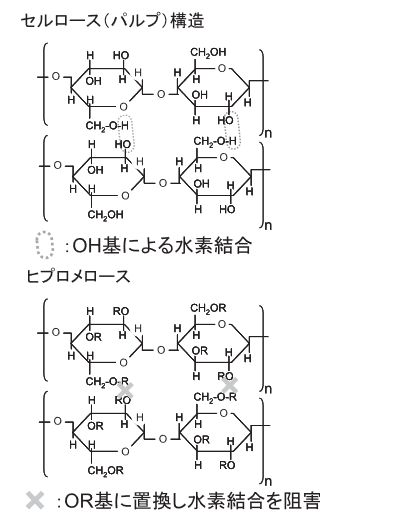
ゼラチンは冷やすことで固まるという性質を持っていましたが、HPMCはその逆で熱を加えると固まる性質を持ちます。
加熱によって周囲の水分子との水素結合が切れることでゲル化が進むためです。
そこでHPMC系の材料をゼラチンと同じ方法で製造するためには、カラギーナン、ジェランガム、ペクチン、寒天、アルギン酸ナトリウム等の低温でゲル化する素材を組み合わせることになります。
もしくはHPMCの熱ゲル化の特性をそのまま利用する場合には、形成ピンを熱した状態でHPMC水溶液に浸漬させることで、熱によるゲル化を促します。
今回の特許は熱ゲル特性を生かした後者の方法が使われています。
しかし、HPMCは非イオン性で広いpH範囲で溶解するため、胃では溶けずに腸で溶けるという腸溶性カプセル剤にはそのままでは使えません。
そこで腸溶性カプセル剤の原料として代わりに使われるのが、ヒプロメロース酢酸エステルコハク酸エステル(HPMCAS)です。
ヒプロメロース酢酸エステルコハク酸エステル(HPMCAS)
ヒプロメロース酢酸エステルコハク酸エステルという長い名前ですが、
先ほど出てきたヒプロメロース(HPMC)のOR基(R=CH3 or CH2CH(CH)3OH)の部分の一部を置換して、酢酸またはコハク酸とのエステル結合の形に変えたものです。
エステル結合を作る際は、カルボン酸のカルボキシル基(-COOH)からOHが取れますが、残ったRCO-の部分をアシル基といいます。
その中でも、
・酢酸からOHが取れた残りのアシル基をアセチル基(Ac基:-COCH3)、
・コハク酸の2つのカルボキシル基のうち、片方からOHが取れた残りのアシル基をスクシニル基(Suc基:-COCH2CH2COOH)、
といいます。
下図はHPMCASの構造式です。赤色の部分がアセチル基、青色の部分がスクシニル基です。
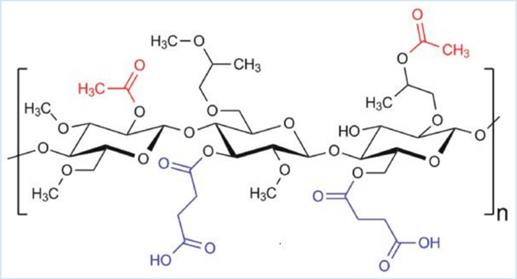
アセチル基は疎水性ですが、極性をもつカルボキシル基が一つ残っているスクシニル基は親水性です。
そこでアセチル基とスクシニル基の導入割合を変えることで、特定の条件で溶けるように調整することができます。
腸溶性カプセル剤として使用するためには、pHが小さい酸性条件下(胃の環境)では溶けず、弱アルカリ性条件下(腸の環境)では溶ける必要があります。
このような特性を持たせるために、アンモニアが中和剤として使われています。
スクシニル基の中のカルボキシル基と反応して中和します。
HPMCASをアンモニアと中和させて塩にしておくことで、
胃に入ったときは弱酸の遊離が起きて元のカルボン酸に戻るため不溶となり、腸の環境では再びイオンとなって溶けます。
HPMCASの熱ゲル化特性
先述の通り、HPMCから作られるHPMCASは、熱を加えることで固まるという熱ゲル特性を持ちます。
【請求項3】のゲル強度に関して、実施形態に次のような説明があります。
【0015】
HPMCASの熱ゲル特性は、貯蔵弾性率G’(5→90℃)と損失弾性率G”の関係を用いて評価する。一般に損失弾性率G”とは、溶液の粘性成分、つまり流体の運動にともなって、流体が変形され抵抗を生じる性質の成分を表す。
(中略)
貯蔵弾性率G’(5→90℃)及び損失弾性率G”は、測定系の温度が上昇するに従い値が変化し、損失弾性率G”(5→90℃)と貯蔵弾性率G’が等しい値、つまりG”/G’=1となるときの温度をゲル化温度とした。また、加熱された成形ピンが腸溶性硬カプセル用組成物に浸漬した時の成形ピンの表面温度が60℃付近と想定されたため、60℃における貯蔵弾性率G’をゲル強度として評価した。
【0016】
スクシニル基モル置換度と当量のアンモニアにより中和されたHPMCAS15質量%水溶液のゲル化温度は、好ましくは5~60℃、より好ましくは10~60℃であり、更に好ましくは15~50℃である。ゲル化温度が5℃未満ではゲル化温度が低すぎるため、常温での腸溶性硬カプセル用組成物の流動性が低下する場合がある。また、ゲル化温度が70℃超過ではカプセル成形時に液だれが発生し、均一な膜厚のカプセルを得ることができない場合がある。
【0017】
スクシニル基モル置換度と当量のアンモニアにより中和されたHPMCAS15質量%水溶液の60℃におけるゲル強度は、好ましくは10Pa以上、より好ましくは20Pa以上、更に好ましくは40Pa以上である。ゲル強度が10Pa未満では、カプセル成形時に液だれが発生し、均一な膜厚のカプセルを得ることができない。ゲル強度の上限は特に制限されないが、膜厚制御の観点から1000Pa以下が好ましい。
この意味について次で確認します。
動的粘弾性
多くの高分子は粘弾性、つまり弾性と粘性を持ちます。
弾性とは、外から物体に力を与えたときに、物体が元に戻ろうとする力です。
例えば、ゴムボールを指で押したときに跳ね返る力です。
粘性とは、外から物体に力を与えたときに、流体が変形に対して示す抵抗性のことです。
例えば、蜂蜜をスプーンですくおうとすると生じる粘りなどです。
粘弾性には動的粘弾性と静的粘弾性があります。
静的粘弾性:途中で変化しない一定の力を加えたときの材料の変形を測定
動的粘弾性:時間とともに変化する振動や繰り返し応力下での材料の応答を測定
今回の特許では、製造過程で繰り返し力を加えることを想定して、動的粘弾性を評価しているものと思われます。
動的粘弾性は、貯蔵弾性率(G’)と損失弾性率(G”)という2つの成分に分けられます。
貯蔵弾性率(G’):
物体の弾性、固さに関する成分です。
外から物体に力を与えたときに、外力とひずみにより生じたエネルギーを内部に保存する性質です。
損失弾性率(G”):
物体の粘性、流動性に関連する成分です。
外から物体に力を与えたときに、外力とひずみにより生じたエネルギーを熱エネルギーとして散逸する成分を表します。
高分子の運動は周囲の高分子との摩擦によって摩擦を受けてエネルギーを損失します。
G’とG”は単位Paで表され、
G’ > G”の場合、材料は主に弾性的な挙動を示します。
G” > G’の場合、材料は主に粘性的な挙動を示します。
完全な弾性体あるいは粘弾性になるということはなく、どちらの性質が強く出るかによって材料の全体的な性質が決まります。
そこで材料の全体的な性質を表すのに、G’とG”の比をとった損失係数 tan δ(tan δ = G”/G’)という指標が使われます。
この特許では、温度を5℃から90℃まで変化させて、G”/G’=1となる温度がゲル化温度であるとしています。
・G” > G’の範囲では粘性や流動性が主となるゾル状態、
・G’ > G”の範囲では弾性が主となるゲル状態、
ということになります。
明細書にグラフはついていませんでしたが、大まかに以下のようなグラフになるかと思います。
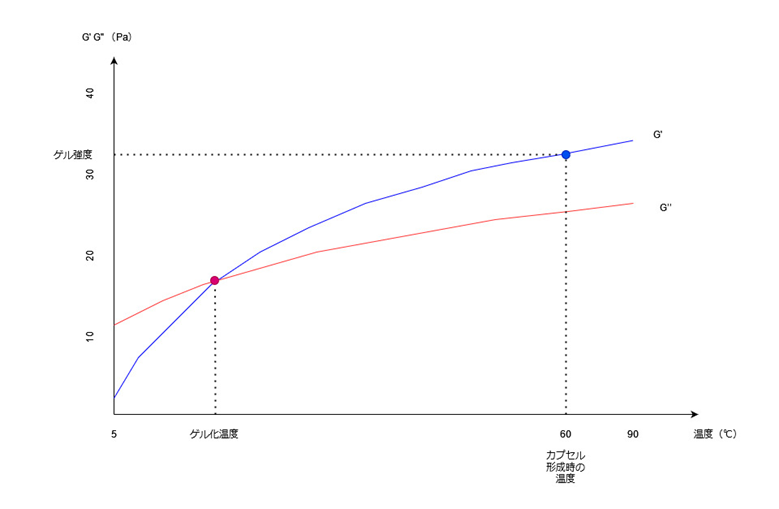
・貯蔵弾性率(G’)を青色の線、
・損失弾性率(G”)を赤色の線、
で表しています。
2つの線がちょうど交差するときにG”/G’=1となるので、このときの温度がゲル化温度になります。
また加熱した形成ピンを溶液に浸したときの表面温度60℃におけるG’をゲル強度としています。
このゲル化温度が5℃未満だとゲル化が進み過ぎて流動性が低下してしまいます。
逆にゲル化温度が70℃以上だと、カプセル形成時の60℃ではG” > G’となるためまだゲル化が生じておらず、形成ピンを溶液に浸しても液だれしてしまいます。
また、カプセル形成時の60℃でのゲル強度が10Pa未満だとG”の値の方が大きくなってしまい液だれが生じるということです。
アセチル基とスクシニル基の置換割合とゲル化の関係
明細書の表1では、アセチル基とスクシニル基の置換割合を変化させて、実施例と比較例でゲル化の様子をまとめています。
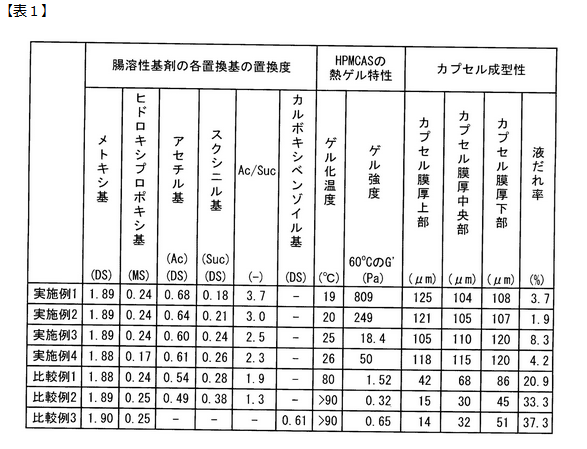
アセチル基とスクシニル基の置換割合によって、ゲル化の様子を確認しています。
アセチル基が多いほど水に溶けにくくなるためゲル化しやすく、
スクシニル基が多いほど水に溶けやすくなり流動性が増します。
スクシニル基がある一定の割合を超えて多くなると、形成ピンを引き上げたときにカプセル原料となる液がしたたり落ちる液だれが起こります。
アセチル基とスクシニル基の比(Ac/Suc)が2.0よりも少ない、つまりスクシニル基に対するアセチル基の割合が比較的少ない比較例では、カプセルの膜厚が全体的に薄くなっており、液だれが起きたことが読み取れます。
DSとMS
表中にはDSやMSという記号が書かれていますが、その意味について確認します。
置換度(degree of substitution, DS)
表中のDSは、置換度(DS 値:Degree of Substitution)の意味で、HPMCASの構成単位であるグルコース単位あたり、いくつのOH基が置換されたかを平均で表した値です。
HPMCASのセルロース骨格は下図のようなβ-グルコースがつながってできていますので、置換できるOH基は赤枠で囲んだ2位・3位・6位の炭素原子のOH基です。
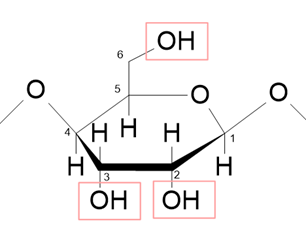
置換できるOHは3個までなので、DSは0~3までの値を取ります。
個々のグルコース単位で見れば0、1、2、3の整数値を取りますが、ある部分は1、ある部分は3、・・・となり、その平均を取るため、多くの場合は小数点で表されます。
モル置換度(moles of substitution, MS)
表中でヒドロキシプロポキシル基だけがDSではなくMSとなっているのを疑問に思われたかもしれません。
MSはモル置換度(moles of substitution, MS)といい、いくつの置換基が結合したかを置換基の平均数で示したものです。
ヒドロキシプロポキシル基(-OC3H6OH)のように置換基自体にもOH基が含まれている場合は、置換基のOH基がさらにまた置換されて、グルコースの一つのOH基に2つ以上の置換基がつく場合があります。
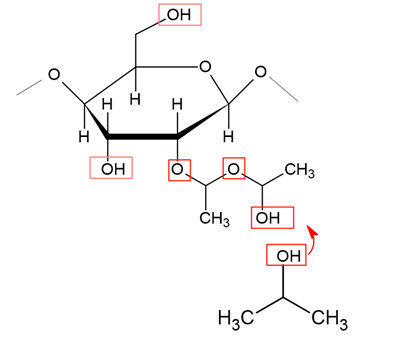
DSの場合は3が上限でしたが、MSの場合は理論上の上限はありません。
置換基自体にOHが含まれる場合はDSではなく、MSで表されるというわけです。
崩壊試験
表2は腸溶性錠剤に関する特許で見たのと同じく、法改正試験によって酸性条件下では溶けずに弱アルカリ性条件下では崩壊するという、
腸溶性の条件を満たしているかを確認したものです。
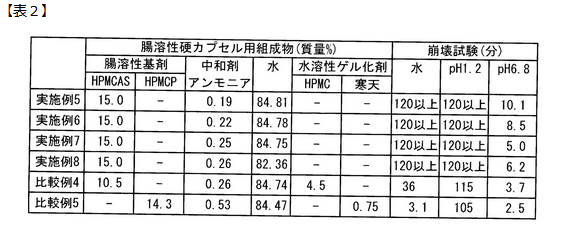
これを見ると、アセチル基とスクシニル基の比(Ac/Suc)が2.0よりも少ない比較例4と5は、酸性条件や水でも120分以内に崩壊が起きており、不適合です。
しかし、Ac/Sucを適切に調整した実験例5~8は、酸性条件と水には120分経っても崩壊せずに、弱アルカリ性条件では10分程度で崩壊しており、腸溶性の条件を満たしています。
以上のことから、この特許の腸溶性硬カプセルは、
・耐水性、耐酸性、機械的強度に優れ、
・狂牛病汚染による影響がなく、
・従来のゼラチンカプセルで使用する設備をそのまま使用して工業的に大量生産ができる、
ということです。
参考)
・丹野史枝 「固体分散体キャリヤとしての添加剤HPMCAS(ヒプロメロース酢酸エステルコハク酸エステル)の物性に関する考察─ in vitro 溶出改善性データを基に─」 薬剤学, Vol.73, No.4, 2013
・田島千恵子, 金子重雄, 市原久雄, 杉原正泰 「硬カプセル剤の内容医薬品とカプセルの強度との関係」 病院薬学, Vol.4, No.4, 1979
・星登 「非ゼラチンカプセルの原料」 薬剤学, Vol.68, No.1, 2008
・共同技研化学 ”動的粘弾性と粘着剤の関係” https://www.kgk-tape.co.jp/randd/nendansei190811.pdf (参照2024-08-14)
・五十野善信「動的粘弾性とは何か」 日本ゴム協会誌, Vol.74, No.6, 2001
8/12(日)学習時間:10.5H
・岡野の化学(199)~(203)
・腸溶性カプセル剤に関する特許読了
・0514 二足の草鞋の履き方
・3660 応募書類の整え方
8/13(月)学習時間:6H
・岡野の化学(204)
・金属元素についてまとめ
・徐放性錠剤に関する特許読了
・1595 マズローの欲求段階とCV作成
・1111 トライアル応募前のチェックポイント
8/14(火)学習時間:5H
・腸溶性カプセル剤に関する特許のまとめ










コメントを残す