今回は、Bio-Rad社のドロップレットデジタルPCR(ddPCR)という技術について紹介しつつ、同社の特許(WO2014205447A2)から一部を抜粋して日本語訳を検討してみたいと思います。
以前の記事では、DNAを人為的に増幅させるPCR法について紹介しました。
今回取り上げる特許は、エンドポイントPCR、リアルタイムPCR、に続く第三世代のPCR法であるデジタルPCR、そのなかでもドロップレットデジタルPCRと呼ばれる技術を用いたものです。
この技術により、PCRの反応室となる液滴生成を、微細加工技術により作られた小さなチップ上で自動的に行えるシステムが実現しました。
この特許自体はPCR反応や蛍光検出に外部装置を使用しますが、将来的に試料の導入から検出までを包括的に行うラボオンチップとしての実現可能性を持った特許といえるでしょう。
PCRの進化―PCRの3つの世代
PCRには大きく以下の3つの世代があります。
- 第一世代: エンドポイントPCR
- 第二世代: リアルタイムPCR
- 第三世代: デジタルPCR
いずれも基本的には以下の3ステップの繰り返しによって目的DNAを増幅します。
この3つの温度変化を繰り返すことを温度サイクルと呼び、通常25~40サイクル程度繰り返すことで、目的のDNAを指数関数的に増幅させます。
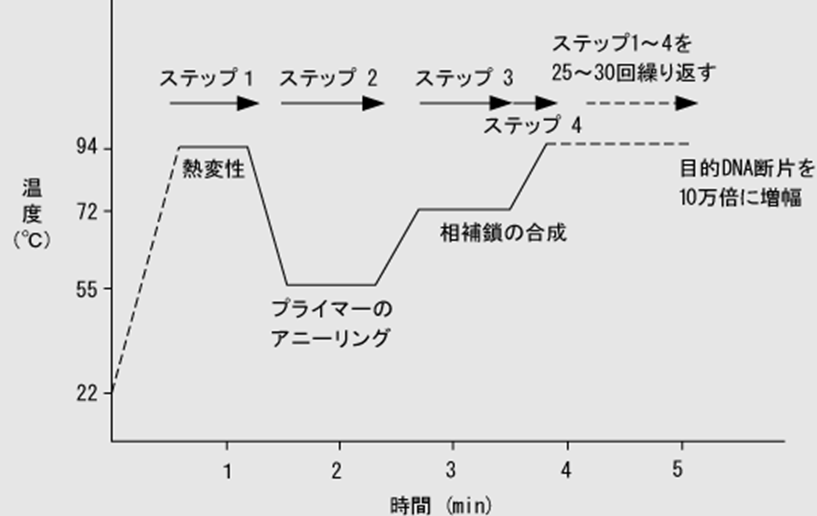
しかし、温度サイクルの前段階や増幅産物の検出方法には3つの世代にそれぞれ異なる特徴があります。
第一世代:エンドポイントPCR
エンドポイントPCRは、以前の記事でも紹介した初期のPCR法です。
25~40サイクル程度の増幅サイクルが完了したのちに、アガロースゲルなどを用いた電気泳動を行うことで、目的のDNAが増幅されていることを検出します。
電気泳動を行うと、下図のようなバンドが得られます。
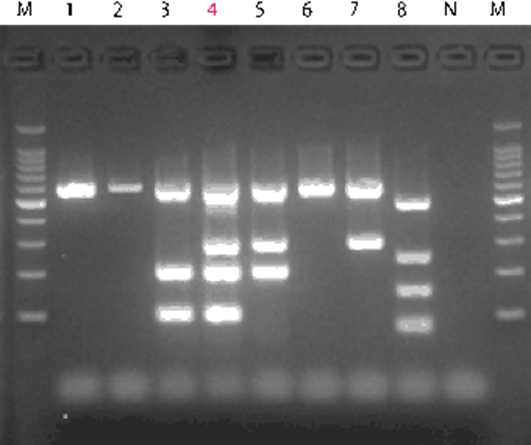
ゲルは網目の役割をし、網目に引っ掛かりやすい長いDNAは移動距離が短いためゲルの上部にバンドができ、短いDNAは網目をくぐって素早く移動することができるためゲルの下部にバンドができます。
またバンドの濃さはDNA量を表し、DNA量が多いほどバンドが濃くなります。
このように、エンドポイントPCRでは、サイクル完了後電気泳動を行い、得られるバンドの長さと濃さによってPCR反応を確認します。
この方法は簡便でコストも抑えられますが、
・増幅から検出までに時間がかかること
・正確なコピー数の定量が難しいこと
などが課題となります。
第二世代:リアルタイムPCR
第二世代は、リアルタイムPCR(またはquantitative PCR;qPCR)です。
第一世代のエンドポイントPCRは、全てのサイクルが完了した後、すなわちエンドポイントでの検出でした。
これに対してリアルタイムPCRは、その名の通り、増幅サイクル途中でのリアルタイム検出を可能にした方法です。
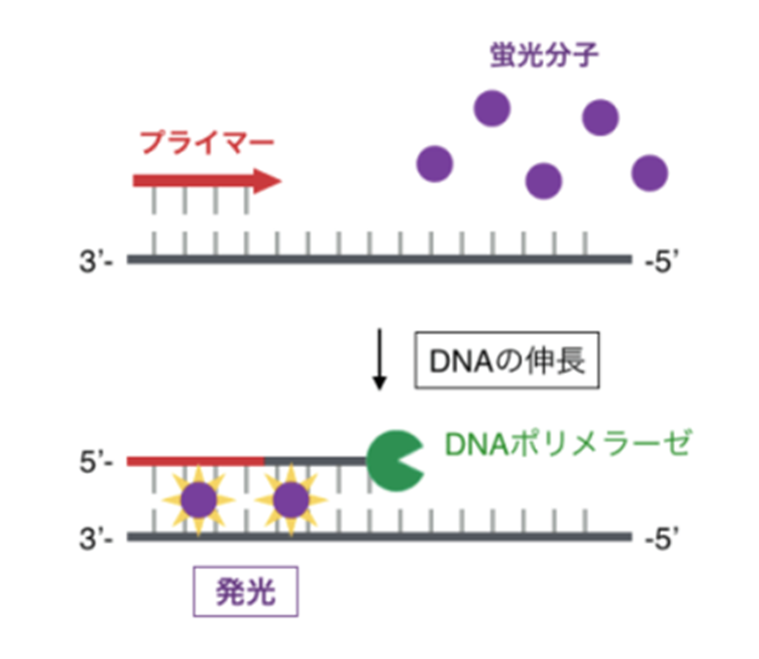
リアルタイムPCRでは、蛍光物質を用いて増幅産物を検出します。
検出方法は主に、インターカレーター法とプローブ法の2通りがあります。
インターカレーター法では、二本鎖DNAに特異的に結合することで蛍光を発する蛍光物質を用います。
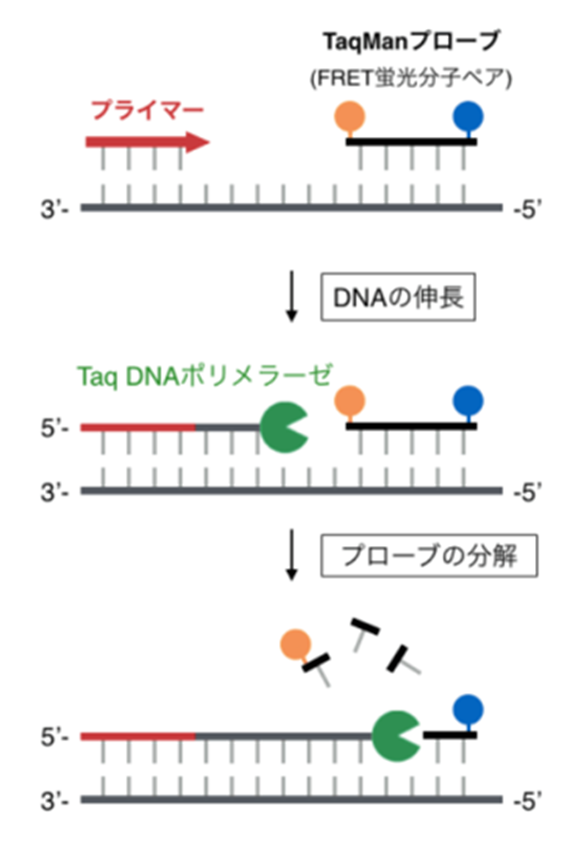
プローブ法では、5’末端を蛍光物質で修飾し、3’末端をその蛍光を抑えるクエンチャという物質で修飾した、蛍光プローブと呼ばれる短いDNA断片を鋳型DNAに結合させます。
Taqポリメラーゼによる伸長反応が進んでプローブが壊されると、クエンチャと切り離された蛍光物質が蛍光を発するようになります。
続いて、上記の蛍光物質による蛍光の強度から未知のDNA量を求めます。
これには、増幅曲線と検量線を用います。
リアルタイムPCRでは、まず既知濃度のDNAを段階的に希釈して、それぞれPCR反応を行い、反応曲線を作ります。
増幅曲線は、横軸にPCRのサイクル数、縦軸に蛍光強度(PCR産物量)を取ります。
サイクル数が増えていくと、目的のDNAが増幅されていき蛍光強度が強まるため、増幅曲線が立ち上がります。そして、反応が飽和するとプラトーに達し、曲線は横ばいになります。
最初のDNA濃度が高いほど少ないサイクル数で増幅が進むため、濃度を薄めるにつれて曲線は右側にシフトしていき、理想的には等間隔に並んだ増幅曲線が得られます。
ここで一定の蛍光強度を示すところに閾値(Threshold)を設定し、その閾値と増幅曲線が交わる点をCt(Threshold Cycle)値とします。
続いて、増幅曲線を元に検量線を作成します。
試料濃度とCt値を軸に取り、先ほどの増幅曲線から得られたCt値をプロットしていくと、一直線の検量線ができます。
検量線が用意できたら、実際に濃度を求めたいDNAサンプルでリアルタイムPCRを行い、測定された蛍光強度を検量線に当てはめることで、元のDNA濃度を求めることができます。
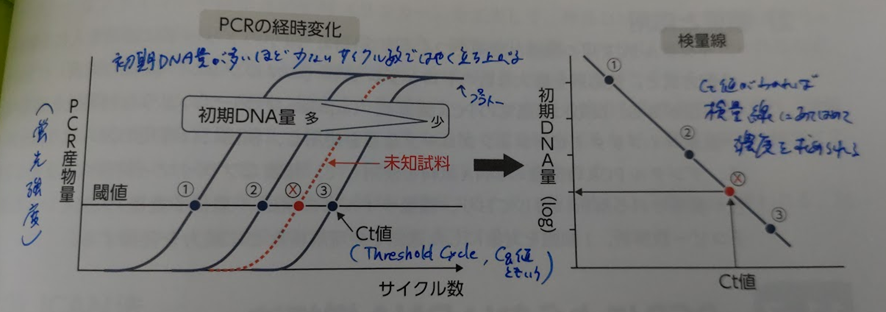
このようにして、DNAの増幅量をリアルタイムで測定し、増幅曲線と検量線に基づいて未知試料の初期濃度を定量できるようになり、ウイルスの定量などが可能になりました。
しかし、リアルタイムPCRは増幅中でのリアルタイム検出を行うことができる一方で、増幅効率の影響を受けやすいという課題があります。
第三世代:デジタルPCR
第三世代となるデジタルPCRは、これまでの2つのPCRと違い、まず試料を多数の微小区画に分け、それぞれの区画でPCRを行います。
各区画はナノリットルサイズの非常に微量なもので、そこにDNAがそれぞれ0~3コピー程度ずつ入ります。
そして、全てのサイクル完了後に蛍光物質を用いて各区画での増幅の有無を調べ、それを増幅あり・なしの区画数の比として定量します。
このように、反応が出れば1、出なければ0という、1か0かの絶対定量による検出方法が「デジタル」PCRと呼ばれる所以です。
デジタルPCRには、主に次のような3つの利点があります。
- メリット1:検量線を必要としない
上述のとおり、リアルタイムPCRでは、濃度未知試料の蛍光強度からCt値を求め、それをあらかじめ作っておいた検量線と比較して定量しますが、dPCRではこのような検量線は不要です。
- メリット2:エンドポイントでの検出により、増幅効率の影響を受けにくい
dPCRは、反応液全体を数千〜数百万の微小区画に分けて、それぞれでPCRを行います。標的DNAの有無が判定対象であり、「あるならPCRで増幅されて蛍光シグナルが出る」、「ないなら何も起きない」という0か1の世界です。
このため、PCRの効率が多少悪くても、最終状態のみで増幅の有無を判定することができ、PCR効率に左右されにくく、非常に再現性の高い絶対定量が可能になります。
- メリット3:微小化による反応の高速化
デジタルPCRでは試料を非常に微小な区画に分けるため、PCRで必要とされる温度サイクルも各区画に伝わりやすく反応速度も上がります。また、一つ一つの区画が小さいため、すべての区画の増幅有無を一度に読み取ることができます。
このため、リアルタイムでの測定ができなくても、十分に高速化できるのです。
デジタルPCRにおける2つの分画技術
デジタルPCRを実現するには、まず試料を小さな反応区画に分画する必要があります。
このための方法には、大きく分けて、ウェルチップ方式とドロップレット方式の2種類があります。
ウェルチップ方式
ウェルチップ方式は、マイクロチップ上に非常に小さなウェル(くぼみ)を多数設け、それぞれのウェルに試料を分配するという方式です。
分配後のチップに温度サイクルを与えてPCRを行います。
このとき、各ウェルは独立した反応空間として機能します。
検出にはリアルタイムPCRのときと同様、蛍光物質を用います。
ただし、先ほど説明したようにリアルタイムPCRとは異なり、全てのサイクルが完了した後に、蛍光を読み取ってウェルごとの増幅の有無を確認します。
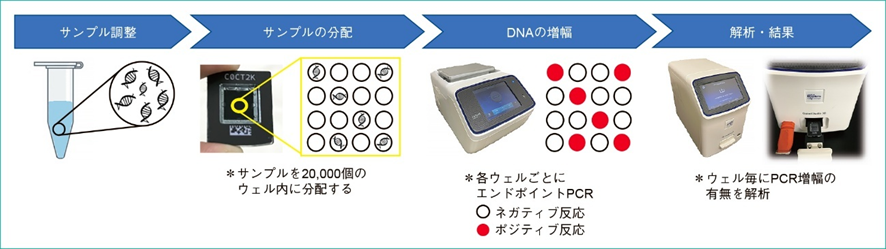
ウェルチップ方式としては、Thermo Fisher Scientific社の製品が代表的です。
ドロップレット方式
ドロップレット方式(ドロップレットデジタルPCR、ddPCR)は、今回取り上げるBio-Rad社の特許で使用されている方式です。
基本的な流れはウェルチップ方式と同様ですが、試料をマイクロチップ上の微小ウェルに分配する代わりに、微小なドロップレット(液滴)を作り、各液滴を反応空間として用いるという点が特徴的です。
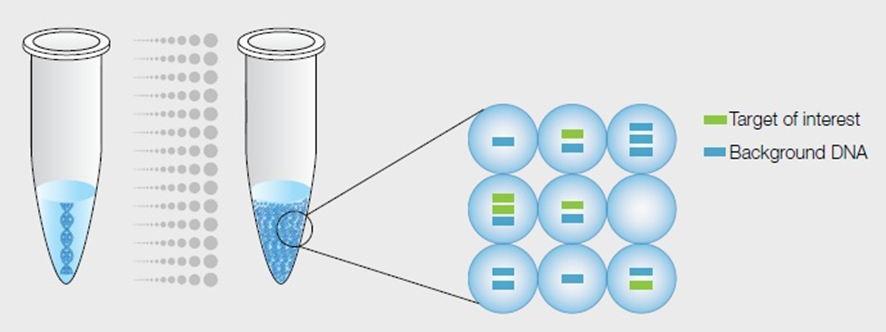
ドロップレットの生成には、例えば油中水型(W/O)エマルションなどのエマルションを利用します。
水と油は溶け合うことはありませんが、一方が非常に小さな液滴になることで他方の中に均一に分散した状態を作ることができます。
このように、本来溶け合わない物質の一方が微粒子となって他方の中に分散している系のことをエマルションと呼びます。
W/Oは、Water in Oilの意味で、油の中に非常に小さな水の液滴が分散しているエマルションです。身近なところでは、バターやマーガリンなども油中水型エマルションと言えます。
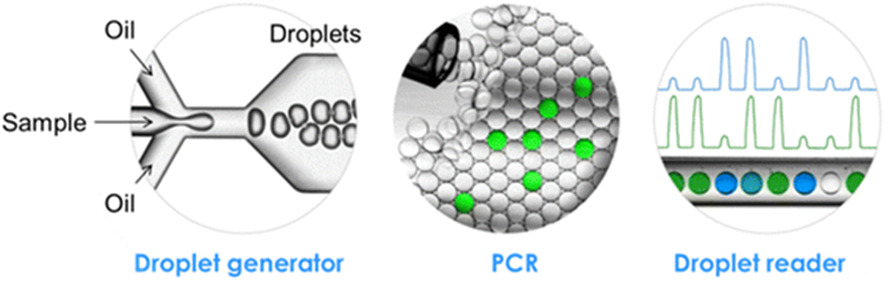
例えば、専用の液滴生成装置を使い、下の一番左側の図のように、試料の小さな液滴を油の中に分散させることができます。
これらの液滴をPCRで増幅し、蛍光を読み取って各液滴の増幅の有無を調べます。
ラボオンチップ技術とその意義
上述のデジタルPCRは、試料をナノレベルに分画するということで、ラボオンチップと呼ばれる技術と非常に親和性の高い技術です。
ラボオンチップとは
ラボオンチップ(Lab on a chip;LOC)は、半導体微細加工技術などを利用した、マイクロ・ナノサイズのバイオデバイスです。
それまでは実験室レベルで行われていた試料と試薬の混合、反応、分離、検出といった操作を、手のひらサイズの小さなチップ上に統合し、一連の操作を自動的に行えるようにするという画期的な技術です。

ラボオンチップのメリット
ラボオンチップには以下のようなメリットがあります。
- 試料導入から検出までを包括的に行える
- 高速PCRが可能
- 低コスト化
- 現場型診断(POCT)に対応
先ほど説明したように試料導入から検出までを包括的に行えるほか、
反応空間の微小化により熱伝導効率が向上して増幅反応が高速化し、また多数の区画の検出を一度に行えるといったことから、非常に効率のよいPCRが実現します。
使用する試料や試薬が少なくて済むため、低コスト化にもつながります。
また、第二世代のリアルタイムPCRでウイルスの定量などが可能になったことにより、PCRは臨床での用途が拡大しました。
ラボオンチップとPCRを融合することで、ポータブルで迅速な検査が可能になるため、POCT(Point of Care Testing)と呼ばれる検査室外での迅速・簡易的検査にも対応できるようになります。
PCRは、
・感染症診断
・微量なDNAを検出する法医学分野
・食品検査や水質検査などの環境モニタリング
など、様々な用途で用いられているため、ラボオンチップ技術との組み合わせにより各分野への応用が期待されます。
Bio-Rad社特許WO2014/205447の概要
ddPCRの概要を確認したところで、Bio-Rad社の特許(WO2014/205447)の内容に入りたいと思います。
発明が解決しようとする課題
ドロップレットPCR自体はこの特許以前にすでに技術として確立されていましたが、液滴生成において、従来の液滴生成システムでは以下のような課題がありました。
- 処理後に空気が液滴中に吹き込まれて生成した液滴を損傷してしまう
- マイクロ流体デバイスでは、適切なタイミングで試料を導入するためにバルブやエアトラップが必要で、製造が複雑になり操作も煩雑になる
解決策
そこで、この特許では、以下のような工夫により、この問題を解決しました。
1. デバイスの基本構成
このデバイスは、主に2つのコンポーネントから構成されています。
①ウェル要素:
複数のウェル(試料が貯蔵されたウェル、油などのキャリア流体を貯めたウェル、試料がキャリア流体中に分散されたエマルションを回収するエマルションウェル、真空環境を作り出すための真空ウェル)を備えた下部構造
②チャネル要素:
マイクロ流路と吸引管を備えた上部構造
2. 圧力差を利用した流体制御
各ウェルから上部のチャンネルコンポーネントに向けて吸引管が延びています。通常は重力により毛細管現象が制限され、試料はウェル内にとどまります。
しかし、真空状態にすることで、圧力差により、試料とキャリア流体(油)が各々の吸引管を通じて吸い上げられ、流路の交差部(液滴生成部)で合流して微小な液滴が生成されます。
生成された液滴は下方のエマルションウェルに落下して収集されるため、空気の混入による損傷を防ぐことができます。
3. バルブレス設計の採用
従来のマイクロ流体デバイスでは、試料が毛細管現象により自然に流路内に入り込んでしまうのを防いで適切な液滴生成を行うために、バルブ等を使用していました。
しかし、この特許ではバルブを使用せず重力と圧力差のみで流体を制御する「バルブレス」設計を採用しています。
これにより、デバイスの製造が簡素化され、操作も容易になります。
4. 熱かしめによる封止機能
液滴生成後、エマルションウェルに通じる流路を熱かしめ(材料を加熱して軟化し、圧力を加えて接合するという方法)で封止することができます。これにより、後続のPCR反応中に液滴が逆流したり、蒸発によって失われたりすることを防ぎます。
このように、この特許では構造設計の工夫によって、従来の液滴生成における課題をうまく解決しています。
液滴生成後のPCR反応(温度サイクル)および蛍光検出は外部装置を利用するため、試料導入から検出までを包括的に行う完全なラボオンチップではありませんが、マイクロ流体技術を用いた液滴生成という重要な工程を小型デバイス上で実現した技術となっています。
和訳の検討
以上で本特許(WO2014/205447)の概要を説明しました。
ここからは英語原文と、その公開訳を参照しながら、和訳を検討していきたいと思います。
和訳検討箇所① ddPCRの概要説明部分
まず、ddPCRの概要について説明している箇所を取り上げます。
特に以下で検討する部分をマーカーしています。
【原文】
Splitting a sample into droplets offers numerous advantages. Small reaction volumes (e.g., picoliters to nanoliters) can be utilized, allowing earlier detection by increasing reaction rates and forming more concentrated products. Also, a much greater number of independent measurements (e.g., thousands to millions) can be made on the sample, when compared to conventional bulk volume reactions performed on a microliter scale. Thus, the sample can be analyzed more accurately (i.e., more repetitions of the same test) and in greater depth (i.e., a greater number of different tests). In addition, small reaction volumes use less reagent, thereby lowering the cost per test of consumables. Furthermore, microfluidic technology can provide control over processes used for the generation, mixing, incubation, splitting, sorting, and detection of droplets, to attain repeatable droplet-based measurements.
【公開訳】
試料を液滴に分割することは、多数の利点をもたらす。小反応体積(例えば、ピコリットルからナノリットル)を利用することができ、これは、反応速度を増大させ、より濃縮された生成物を形成することで、より早い検出を可能にし得る。また、マイクロリットルスケールで実施される従来のバルク体積反応と比較したときに、かなり多数の独立した測定(例えば、数千から数百万)が試料に対して行われ得る。したがって、試料は、より正確に(すなわち、同じ検査のより多くの繰り返し)、より深く(すなわち、より多数の異なる検査)分析され得る。それに加えて、小反応体積では、より少ない試薬を使用し、それによって、消耗品の1検査当たりの費用を低減する。さらに、マイクロ流体技術は、液滴の生成、混合、インキュベーション、分割、分類、および検出のために使用されるプロセスを制御し、これにより繰り返し可能な液滴ベースの測定を達成することができる。
まず、以下の部分を見てみましょう。
“Small reaction volumes (e.g., picoliters to nanoliters) can be utilized, allowing earlier detection by increasing reaction rates and forming more concentrated products.”
ここで原文の言いたいことをざっくりとまとめると、以下のような内容になるかと思います。
- 反応系としての総量がピコ~ナノリットルと非常に小さくできることで、(熱効率の向上によってPCRサイクルが効率的に行われるなど)反応速度が増大し、
- それによって1つの区画あたりの標的DNAの濃度が高まり、
- 結果として、早期に蛍光検出されるようになる
公開訳の「小反応体積を利用する」というのは日本語としてやや不自然に感じられるので、「反応液量が少ないことを利用する」などとしてはどうでしょうか。
“bulk volume reactions”は、非常に微量の液滴に分画する本特許の方法と対比的に、従来用いられてきた方法を指しています。
bulkには物体の表面と対になる概念としての意味もありますが、ここでの bulk は、ddPCRの液滴のように小分けにされてはいない、あるまとまった一定量の反応液を意味しているものと思われます。小分けにする前の大容量の試薬として薬品メーカーなどで販売されている「バルク試薬」や「バルク調液」も同様の概念かと思います。
訳としてはどうすべきか迷いましたが、公開訳の「バルク体積反応」という表現は日本語としてやや不自然に感じられるので、私の訳では「バルク量での反応」としました。
また、”concentrated”は、確かに実験操作で「濃縮された」「濃縮した」という意味で使うことが多いですが、ここではPCRによって標的DNAが増幅されることにより、結果として液滴中の増幅産物の濃度が高くなったという文脈です。
「濃縮された」と訳すと、水分を蒸発させたかのようになってしまうので、「濃度の高い」「高濃度の」とした方がよいのではないでしょうか。
“sorting”は、公開訳では「分類」と訳していますが、分類というと、A、B、C・・・などのクラスに分けるイメージになります。
ここでは様々な物質をクラス分けするというわけではなく、ある目的のDNAを選択的に選び取るということなので、「選別」とした方がよいかと思います。
“attain repeatable droplet-based measurements”の”repeatable”に関して、公開訳は「繰り返し可能な」としていますが、「繰り返し可能」というと、同じマイクロ流体デバイスを繰り返し使って同じ測定を何度も行うようなイメージになってしまいそうです。
ここではそうではなく、何度繰り返しても、あるいは誰が行っても、同じ測定結果が得られるということを言っているものと思われます。そのため、「再現性が高い」とすべきかと思います。
ちなみにそれより前に出てくる”more repetitions of the same test”は、「繰り返し」あるいは「反復」でよいと思います。この箇所は、ddPCRでは多数の液滴がそれぞれ別個の検出単位になるため、同種のDNA断片に対して測定を大量に繰り返すことになり、それによって統計的な精度を高められるということであり、上記の再現性とは文脈が異なります。
以上をふまえて、私の考えた訳を、原文、公開訳と並べてみます。
【原文】
Splitting a sample into droplets offers numerous advantages. Small reaction volumes (e.g., picoliters to nanoliters) can be utilized, allowing earlier detection by increasing reaction rates and forming more concentrated products. Also, a much greater number of independent measurements (e.g., thousands to millions) can be made on the sample, when compared to conventional bulk volume reactions performed on a microliter scale. Thus, the sample can be analyzed more accurately (i.e., more repetitions of the same test) and in greater depth (i.e., a greater number of different tests). In addition, small reaction volumes use less reagent, thereby lowering the cost per test of consumables. Furthermore, microfluidic technology can provide control over processes used for the generation, mixing, incubation, splitting, sorting, and detection of droplets, to attain repeatable droplet-based measurements.
【公開訳】
試料を液滴に分割することは、多数の利点をもたらす。小反応体積(例えば、ピコリットルからナノリットル)を利用することができ、これは、反応速度を増大させ、より濃縮された生成物を形成することで、より早い検出を可能にし得る。また、マイクロリットルスケールで実施される従来のバルク体積反応と比較したときに、かなり多数の独立した測定(例えば、数千から数百万)が試料に対して行われ得る。したがって、試料は、より正確に(すなわち、同じ検査のより多くの繰り返し)、より深く(すなわち、より多数の異なる検査)分析され得る。それに加えて、小反応体積では、より少ない試薬を使用し、それによって、消耗品の1検査当たりの費用を低減する。さらに、マイクロ流体技術は、液滴の生成、混合、インキュベーション、分割、分類、および検出のために使用されるプロセスを制御し、これにより繰り返し可能な液滴ベースの測定を達成することができる。
【自分の訳】
試料を液滴に分割することで、多くの利点がもたらされる。反応液量(例えば、ピコリットルからナノリットル)が少ないことを利用でき、反応速度を高め、より高濃度の生成物を得ることにより、早期の検出が可能になる。また、マイクロリットルスケールで実施される従来のバルク量での反応と比較したときに、非常に多くの(例えば、数千から数百万の)独立した測定を試料に対して行うことができる。したがって、試料をより正確に(すなわち、同一の検査のより多くの反復)、かつより深く(すなわち、より多数の異なる検査)分析することができる。加えて、少ない反応液量では試薬の使用が抑えられ、これにより、消耗品の検査1回あたりのコストが低減される。さらに、マイクロ流体技術により、液滴の生成、混合、インキュベーション、分割、選別、および検出に用いられるプロセスを制御し、再現性の高い液滴ベースの測定を実現できる。
和訳検討箇所② PCRにおける区画化の重要性説明部分
続いて、PCRにおいて液滴への区画化がなぜ重要なのかを説明している以下の部分の和訳を検討します。
先ほどと同じく、特に以下で取り上げる箇所をマーカーしています。
【原文】
Compartmentalization of single copies of a nucleic acid target in droplets of an emulsion alleviates problems encountered in amplification of larger sample volumes. In particular, droplets can promote more efficient and uniform amplification of targets from samples containing complex heterogeneous nucleic acid populations, because sample complexity in each droplet is reduced. The impact of factors that lead to biasing in bulk amplification, such as amplification efficiency, G+C content, and amplicon annealing, can be minimized by droplet compartmentalization. Unbiased amplification can be critical in detection of rare species, such as pathogens or cancer cells, the presence of which could be masked by a high concentration of background species in complex clinical samples.
【公開訳】
エマルジョンの液滴中の核酸標的の単一コピーを区分することは、より大きい試料体積の増幅において遭遇する問題を軽減する。特に、液滴は、各液滴中の試料の複雑さが低減されるので、複雑で不均一な核酸集団を含む試料からの、標的のより効率的で均一な増幅を促進することができる。増幅効率、G+C含量、およびアンプリコンアニーリングなどの、バルク増幅においてバイアスを引き起こす要因の影響は、液滴の区分によって最小限度に抑えられ得る。バイアスされない増幅は、病原体または癌細胞などの稀有な種の検出において極めて重要となる場合があり、その存在は、複雑な臨床試料中の高濃度のバックグラウンド種によって隠される可能性がある。
“G+C content”とは、プライマー全体を構成する塩基のうち、G(グアニン)とC(シトシン)の含有量のことです。
グアニンとシトシンは相補的な塩基対で、3つの水素結合を持ちます。
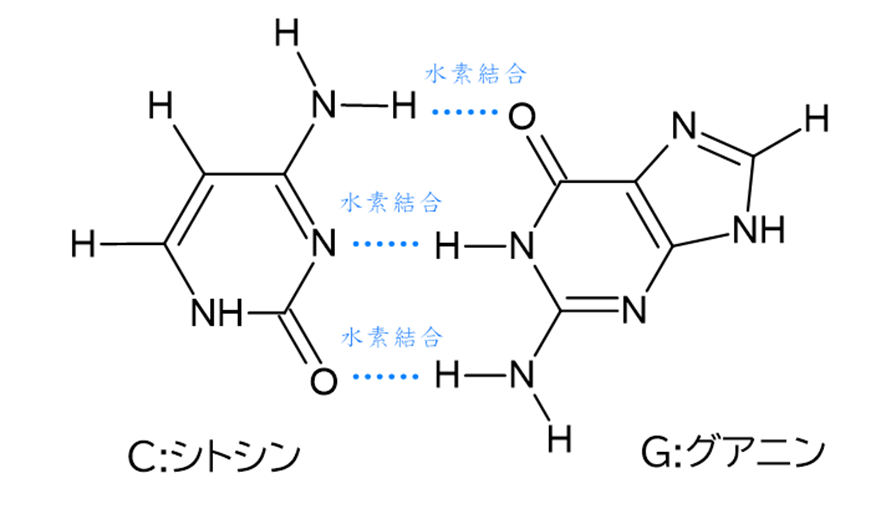
一方、もう一組の塩基対であるアデニンとチミンの水素結合は2つです。
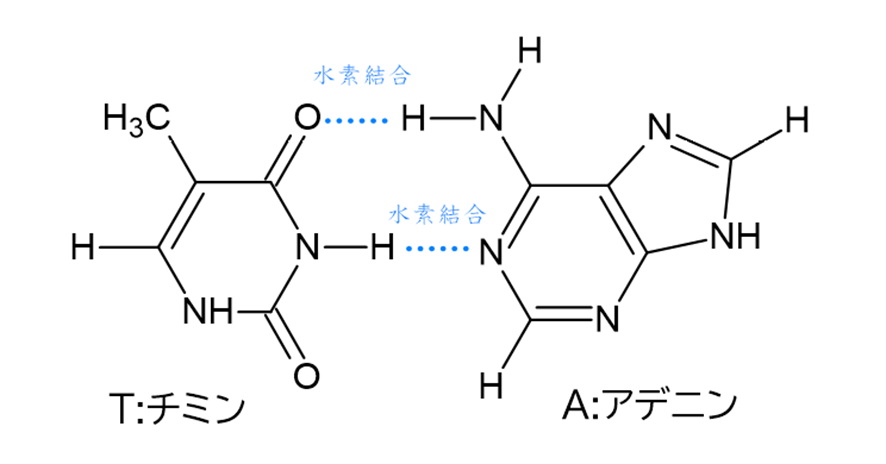
このように、アデニンとチミンのペアに比べて、水素結合の多いグアニンとシトシンはより強く結合するため、プライマー中のGC量が多すぎるとプライマー同士が結合し合う自己ダイマーと呼ばれる状態を生じやすくなり、PCR効率が落ちてしまいます。
そのため、プライマーのGC含量は40~60%程度に設計するのがよいとされています。
日本語では「G+C含量」よりも「GC含量」という表記が一般的なようなので、こちらを採用したいと思います。
“amplicon annealing”の”amplicon”(アンプリコン)は、PCRによってできる反応産物のことです。
アニーリングと言えば、通常はprimer annealing(プライマーアニーリング)のことで、鋳型となる1本鎖DNAにプライマーが結合することを意味します。
一方、”amplicon annealing”は、プライマーではなくアンプリコンが鋳型DNA鎖に結合してしまうというPCR時のトラブルを意味していると思われます。
【参考:再表2016/039377】
PCR法においては、そのサイクル数がある閾値を超えると、反応産物が増加しなくなることが知られている。添加されているdNTPの枯渇や、プライマーと反応産物のアニーリングの競合がその主な原因であるが、この時には反応産物同士のアニーリングが起こっており、変異を有する鋳型と野生型の鋳型が混在していれば、これらから増幅した反応産物同士のアニーリングにより変異部位にミスマッチ塩基対が生じることになる。
また、上記のようなアンプリコン同士のアニーリング以外にも、1本のアンプリコンが自身で結合して二次構造を形成してしまうという現象も考えられます。
そのため、「反応産物同士のアニーリング」とすれば日本語としては自然ですが意味を限定しすぎてしまうかもしれません。
“amplicon annealing”という原文の表現自体あまり定着しているわけではなさそうで日本語の定訳もみつからないため、カタカナで「アンプリコンアニーリング」としておいて、括弧書きで原文を残しておくのがよいかと思います。
続いて、引用箇所の最終文を見ていきます。
“unbiased amplification”の「バイアス」とは、PCRにおいて、上記のGC含有量や増幅産物同士のアニーリングなどにより、PCR増幅結果に偏りが出ることを意味しています。
“rare species, such as pathogens or cancer cells”の”rare species”を公開訳では「稀有な種」と訳していますが、病原体やがん細胞という具体例から考えても、自然界にあまり存在しない希少種ということを言っているわけではないと思われます。
ここでは、標的DNAである病原体やがん細胞などのDNAが試料中に含まれる量が少なく、そのためバイアスがあると他のより多くのバックグラウンドの(標的以外の)核酸種に埋もれてしまい検出できない、ということだと思われますので、「微量の核酸種」などとした方がよいかと思います。
また、バックグラウンドによって標的DNAが検出できなくなってしまうことがないように、バイアスのない増幅を行うことが重要だ、という論理関係になると考えられますので、”the presence of which…” 以下は理由として訳すのが適切かと思われます。
以上をふまえて、私の考えた訳を、原文、公開訳と並べてみます。
【原文】
Compartmentalization of single copies of a nucleic acid target in droplets of an emulsion alleviates problems encountered in amplification of larger sample volumes. In particular, droplets can promote more efficient and uniform amplification of targets from samples containing complex heterogeneous nucleic acid populations, because sample complexity in each droplet is reduced. The impact of factors that lead to biasing in bulk amplification, such as amplification efficiency, G+C content, and amplicon annealing, can be minimized by droplet compartmentalization. Unbiased amplification can be critical in detection of rare species, such as pathogens or cancer cells, the presence of which could be masked by a high concentration of background species in complex clinical samples.
【公開訳】
エマルジョンの液滴中の核酸標的の単一コピーを区分することは、より大きい試料体積の増幅において遭遇する問題を軽減する。特に、液滴は、各液滴中の試料の複雑さが低減されるので、複雑で不均一な核酸集団を含む試料からの、標的のより効率的で均一な増幅を促進することができる。増幅効率、G+C含量、およびアンプリコンアニーリングなどの、バルク増幅においてバイアスを引き起こす要因の影響は、液滴の区分によって最小限度に抑えられ得る。バイアスされない増幅は、病原体または癌細胞などの稀有な種の検出において極めて重要となる場合があり、その存在は、複雑な臨床試料中の高濃度のバックグラウンド種によって隠される可能性がある。
【自分の訳】
エマルション液滴中の標的核酸の単一コピーを区画化することで、より多量の試料を増幅する際に直面する問題が軽減される。特に、液滴にすることで、各液滴中の試料の複雑性が低減されるため、複雑で不均一な核酸集団を含む試料から、より効率的かつ均一な標的の増幅を促進することができる。増幅効率、GC含量、およびアンプリコンアニーリング(amplicon annealing)など、バルクスケールでの増幅においてバイアスをもたらす要因による影響は、液滴を区画化することで最小限に抑えることができる。バイアスのない増幅は、病原体またはがん細胞といった微量の核酸種の検出において極めて重要でありうる。これらの核酸種の存在は、複雑な臨床試料中の高濃度のバックグラウンド核酸種によって隠される恐れがあるからである。
次回、もう少しこの特許の続きを読んでいきたいと思います。
[参考]・田村隆明「基礎から学ぶ遺伝子工学」(羊土社、2022年10月)
・柳原格ほか「デジタルPCRの高感度化と臨床診断への応用」(生物工学会誌、第95巻、第7号、2017年)
・柴山祥枝「デジタルPCRを用いた核酸の正確かつSIトレーサブルな定量に向けた動き」(計測と制御、第60巻、第8号、2021年)
・バイオ-ラッド社サイト「デジタルPCRの紹介」

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/4a47823f.ec7d24f1.4a478240.065a96b7/?me_id=1213310&item_id=20791219&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fbook%2Fcabinet%2F1248%2F9784758121248.jpg%3F_ex%3D240x240&s=240x240&t=picttext)








①熱変性(94~95℃):
高温により二本鎖DNAを一本鎖にほどく
②アニーリング(50~65℃):
温度を下げて、一本鎖になったDNAに複製の手本となるプライマーを結合させる
③伸長(72℃):
Taqポリメラーゼ(熱耐性を持つ、PCR用の特殊なDNAポリメラーゼ)によりプライマーを伸長させる