前回の記事で脱離能、酸の強さについて調べたところをまとめましたが、今回はそれに関連して水の脱離能についてまとめます。
まず、水はわずかに電離していて、H3O+とOH–に分かれています。
H+とOH–で書かれているのもよく見ますが、これはH3O+の省略形なのですね。
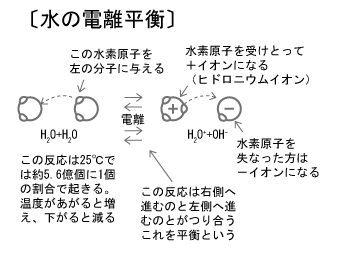
それでも純粋が中性なのはH3O+の濃度とOH–の濃度が等しいからです。
では、脱離基としてのOH–とH2Oにそれぞれ着目してみましょう。
前回の投稿でも使わせていただいた以下の表を見ますと、
OH–とH2O
H2OとH3O+
のそれぞれが共役塩基と酸の関係になっていることがわかります。
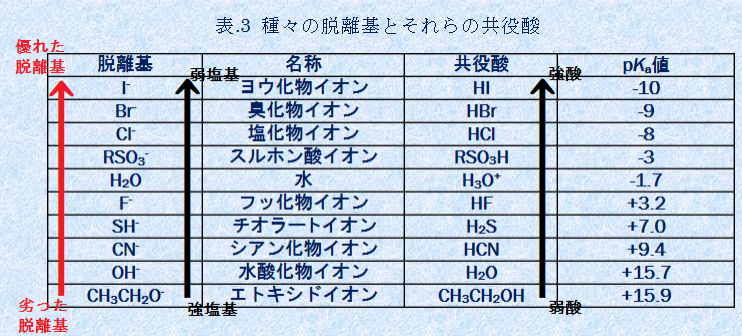
そして、OH–は相対的に劣った脱離基(脱離能が低い、脱離しにくい)、H2Oは優れた脱離基であるということがわかります。
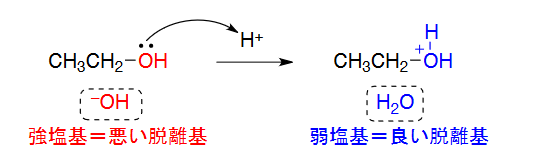
ここまで理解したところで、以前学習した「アルコールの分子内脱水によるアルコールの生成」について確認してみます。
具体例としてエタノールの分子内脱水は以下の反応機構でした。

ここでエタノールの-OH基が最初にプロトン化されてH2Oになることで、
脱離能の低いOH基が脱離能の高いH2Oになって脱離がおきる、という仕組みだったんですね。
その最初のプロトン化のために濃硫酸が使われたということです。
4/22(月)学習記録
・学習時間:4.75H
・岡野の化学(31)
・水の脱離能について
→濃硫酸を使うのはOHをプロトン化するためということはわかっていたが、「何のために」というところがつながっていなかった。これでようやく理解できた。
課題)
フェノールとカルボン酸が酸性になる理由についてまとめる。
岡野の化学も先は長いので、自分の気になったことは都度調べるが深入りしそうだと思ったら少し今後の課題として寝かせておいて講義動画もきちんと進めるようにしたい。
その他視聴したビデオ
・1196
・1153







コメントを残す