前回の記事で固体の溶解度曲線について触れました。
その際、Na2SO4の溶解度がある温度までは右肩上がりなのにある温度を境に右肩下がりになる理由を調べたところ、ある温度を境に水和物から無水物に変化するため、ということが分かりました。
今回は「水和物」「無水物」とは何なのか、日常生活でどのように使われているのか、という点を調べました。
水和物とは?
水和物とは、ある物質に水分子が結合してできた化合物のことです。
例えば、硫酸銅(II)五水和物CuSO4・5H2Oは下図のように、銅イオンに配位結合する水分子4つと、上下の硫酸イオンに挟まれて水素結合する水分子1つ、計5つの水分子と結合しています。
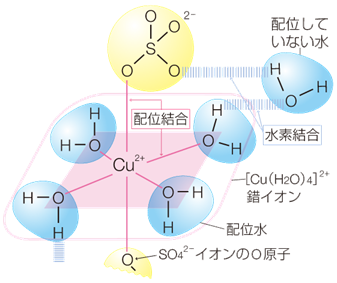
水和物と水溶液はどう違う?
水和とは、溶質が溶媒である水に溶けるとき、クーロン力、水素結合、双極子-双極子相互作用、などの力によって引き付けられた水分子が溶媒分子あるいはイオンを取り囲んで分子集団を作る現象を言います。
このように言うと、水分子と結合した水和物と、水溶液と、どう違うのだろう、と思うかもしれません。
水和物の場合、結合に関わるH2O分子は液体ではなく、固体の状態で結晶の中に取り込まれます。
そして水和物も水に溶けて水溶液になります。ただし、その際には結晶の中に取り込まれていた水分子も溶媒の水と一緒になってしまうので、出来上がるものは無水物(後述します)の水溶液と変わりません。
水和物を構成する水分子は「水和水」「結晶水」「結合水」などと呼ばれ、結合には関与せず自由に動き回れる水「自由水」「付着水」とは区別されます。
水和物ができる条件
水和物ができるにはまず、もとの化合物とH2O分子との相互作用が大きくなる必要があります。
H2Oは分子内に電荷の偏りがある極性分子ですので、上に書いたようにクーロン力、水素結合、双極子-双極子相互作用の影響を受けやすいです。
よって、イオン結合の化合物や極性が大きな化合物、たとえば金属塩などは水和物を作りやすいと言えます
逆に極性を持たない非極性分子は水和物を形成しにくいです。
また、元の物質のイオン半径によっても水分子の引きつけやすさに違いがあります。
傾向としては、イオン半径が大きくなるほど、水和する水分子の数は小さくなります。
イオンの表面積が大きくなるとたくさんの水分子が近づけるのではないの?と思うかもしれません。これは確かにそうです。
しかし、イオン半径が大きくなると表面の電荷の密度が小さくなるため、水分子とのクーロン力は小さくなります。
ここでポイントとなるのは、もとの物質のイオンのまわりを水分子が二重、三重に取り囲んでいるということです。
イオンと直接結合する水分子を第一水和圏の水分子といいます。そして、そのさらに外側を囲んでいるのが第二水和圏の水分子、そのまた外側が第三水和圏の水分子、となっています。
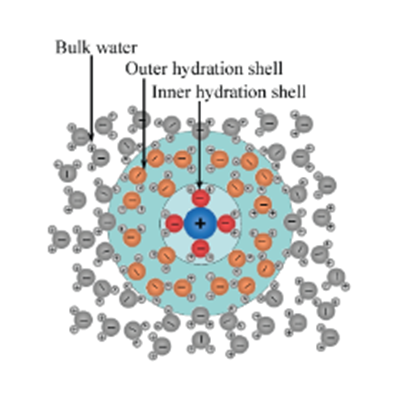
イオンの表面積が大きければ第一水和圏の水分子は多くなりますが、クーロン力が遠くまで及ばないため、第二水和圏以上の水分子と結合する力は弱くなります。
一方でイオンの表面積が小さいと直接結合できる水分子が少なくなるため第一水和圏の水分子は少なくなりますが、逆に表面の電荷密度は大きくなるため、さらに外側の第二水和圏、第三水和圏の水分子とも強く結合します。
結果としてすべての水和圏の水分子との結合を数えると、もとの物質のイオン半径が小さい方がより多くの水分子と結合する傾向がある、ということになります。
水和物と無水物
無水物とは
無水物という言葉にはいくつか意味があります。
一つは脱水縮合の場合です。
例えば、酢酸2分子から水分子がとれて脱水縮合し無水酢酸ができる場合です。
二つ目は水分量が非常に少ないことを表す場合です。
例えば、無水エタノールというと、水分をほとんど含まない、非常に純度の高いエタノールを指します。
三つ目が水和物の対概念となる無水物で、今回の話に関係します。
つまり、水和物に含まれている結晶水がなくなった状態の化合物です。
例えば、Na2SO4・10H2Oという水和物に対して、Na2SO4が無水物です。
無水物と水和物の性質の違い
無水物と水和物とでは物理的・化学的性質に違いがあります。
ここでは、溶解性、吸湿性、安定性の3つを取り上げます。
まずは溶解性の違いです。
溶解性は溶けやすさのことですが、溶解度と溶解速度の2つの面から考えられます。
溶解度については前回の記事でも触れましたが、温度上昇に対する溶解度の変化が水和物と無水物とでは異なります。
溶解度も溶解速度も一般的に水和物の方が無水物よりも高くなります。
これは水和物の結晶格子にすでに水分子が含まれており、溶解が起こる際の結晶を切断するエネルギー、水和に必要なエネルギーがともに少なくて済むためです。
次に吸湿性の違いです。
無水物は水和物に比べて吸湿性が高いです。
無水物が水分子を取り込んで水和物ができる、ということを考えれば納得できると思います。
例えば、無水硫酸マグネシウムは吸湿性の高さを利用して、医薬品や食品の包装パッケージに使われています。
逆に水和物はすでに水分子を取り込んでいるため、吸湿性は低くなります。
最後に安定性の違いです。
一般的に、無水物から水和物を形成する反応は発熱反応になります。
つまり、無水物の方がエネルギーが高い不安定な状態で、水和物の方がエネルギーが低い安定した状態、と考えられます。
水和物・無水物の用途
水和物と無水物の特性は身近なところで利用されています。
医薬品への応用
医薬品では用途に応じて水和物と無水物が使いわけられています。
例えば無水物としてよく使われているのは無水カフェインです。
無水物にすることの利点は、水分子が含まれていない分、同じ量でも水和物に比べて有効成分濃度が高くなるという点です。
そのため、少量で効き目が出やすくなります。
水和物として使われる例としては、アモキシシリン水和物があります。
アモキシシリン水和物は呼吸器感染症や皮膚感染症など様々な感染症の治療薬として経口投与されます。
水和物の場合は上で見たように溶解性が高いという特徴があるため、効率よく体内に吸収できます。
コンクリートでの使用
コンクリートはセメントを水和して硬化したものです。
セメントには次のような化合物が含まれます。
3CaO・SiO2(ケイ酸三カルシウム、アリット)
2CaO・SiO2(ケイ酸二カルシウム、ペリット)
3CaO・Al2O3(アルミン酸三カルシウム)
4CaO・Al2O3・Fe2O3(鉄アルミン酸四カルシウム、セリット)
このセメントに水を加えると、それぞれ以下の水和物に変化します。
3CaO・2SiO2・3H2O
3CaO・2SiO2・3H2O
3CaO・Al2O3・6H2O
3CaO・(Al2O3,Fe2O3)・6H2O
上で見たように、水和物になるとよりエネルギー準位の低い安定した状態になり、
コンクリートの強度と耐久性が実現されるというしくみです。
参考)
・大滝仁志「水の中の分子を見る」化学と教育. 41巻 7号, 1993年
・株式会社リガク ”固体医薬品の評価法③~水和物について調べる~” https://rigaku.com/ja/resources/application-notes/xrd1003-solid-pharmaceutical-drugs-confirming-hydrates(参照2024-07-16)
・小林映章”水の話”コンクリート・プロダクツ・ネットワーク https://www.con-pro.net/readings/water/doc0038.html(参照2024-07-17)
7/16(火)学習時間:4.75H
・岡野の化学(162)
・水和物、無水物について
課題)
・水和物、無水物についての特許明細書を参照する
その他
・文系とAI人材






コメントを残す